Диффузно инфильтрирующая астроцитома с мутацией либо в гене IDH1, либо в IDH2. IDH-мутантная диффузная астроцитома типично характеризуется умеренно плеоморфными клетками и характеризуется высокой степенью клеточной дифференцировки и медленного роста. Диагноз подтверждается наличием мутации ATRX и TP53.
Наличие компонента, морфологически напоминающего олигодендроглиому, совместимо с этим диагнозом при отсутствии 1p / 19q кодирования. Эта опухоль чаще всего поражает молодых людей и встречается по всей ЦНС, но преимущественно расположена в лобных долях. Диффузные астроцитомы обладают внутренней способностью к злокачественной прогрессии к IDH-мутантной анапластической астроцитоме и в конечном итоге к глиобластоме с IDH-мутацией.
ICD-0 code 9400/3
Профилирование
Диффузная астроцитома соответствует гистологически II классу ВОЗ.
Синонимы
Низкоузловая астроцитома (не рекомендуется); Фибриллярная астроцитома (более не рекомендуется)
Эпидемиология
Заболеваемость
Регистры опухолей не различали диффузные астроцитомы на основании статуса мутаций в IDH. Однако, поскольку большинство случаев несут мутацию IDH, имеющиеся данные отражают эту генетически определенную опухолевую сущность в некоторой степени. Диффузные астроцитомы составляют приблизительно 11-15% всех астроцитарных опухолей головного мозга. Годовые показатели заболеваемости оцениваются в 0,55 и 0,75 новых случаев на 100 000 населения.
Согласно некоторым сообщениям, за последние десятилетия в нескольких скандинавских странах и Северной Америке частота астроцитомы у детей несколько возросла. Существует преобладание мужчин, соотношение мужчин и женщин составляет 1,3: 1.
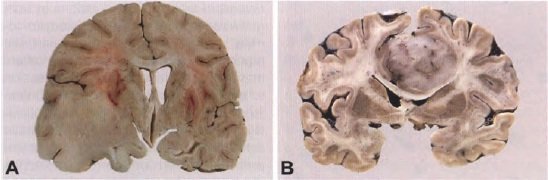
A. Большая диффузная астроцитома, занимающая левую височную долю, с расширением к сильвийской трещине. Обратите внимание на однородную поверхность и увеличение локальных анатомических структур. B. Большая диффузная астроцитома, происходящая из перикаллозальной коры правого полушария. Опухоль распространяется в межполушарную щель и смещает срединную линию к левому полушарию. Макроскопически это повреждение хорошо очерчено и все еще показывает структуры, напоминающие корковые архитектуры.
Распределение по возрасту
Медианный и средний возраст пациентов с диффузными астроцитомами, вызванными IDH-мутацией, приходится на середину 30-х годов. Согласно одному исследованию только у взрослых пациентов, средний возраст пациентов с диффузной астроцитомой, вызванной IDH-мутацией, составляет 36 лет, а средний возраст составляет 38 лет. Эти значения аналогичны значениям для анафилактической астроцитомы, вызванной IDH-мутантом.
Локализация
Диффузные астроцитомы с помощью IDH-мутанта могут быть расположены в любом районе центральной нервной системы, но чаще всего развиваются надпотенциально в лобных долях. Это похоже на предпочтительную локализацию олигодендроглиомы с IDHmutant и 1p / 19q и подтверждает гипотезу, что эти глиомы развиваются из отдельной популяции клеток-предшественников.
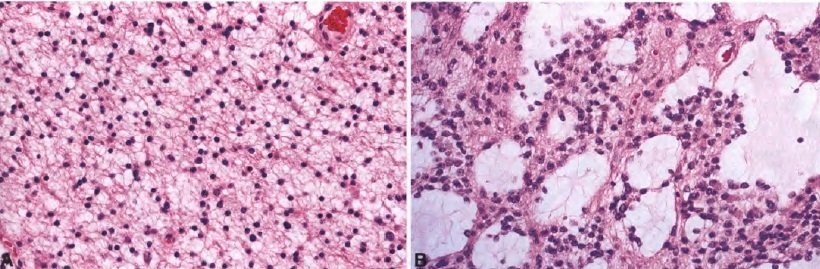
A. Диффузная астроцитома. Умеренно клеточная опухоль, состоящая из однородных неопластических фибриллярных астроцитных клеток. B. Обширное образование микроцист.
Клинические особенности
Приступы — типичный симптом; Однако могут возникать более тонкие отклонения, такие как речевые трудности, изменения в ощущении или зрении, а также некоторая форма двигательных изменений. Симптом начинается редко, и некоторые опухоли диагностируются случайно. При опухолях лобной доли могут быть характерные изменения в поведении или личности. Такие изменения могут присутствовать в течение месяцев до постановки диагноза.
Визуализация
Как и клинические признаки, результаты исследований нейровизуализации могут быть чрезвычайно различными. На КТ диффузные астроцитомы чаще всего представлены как плохо определенные однородные массы низкой плотности без усиления контраста. Тем не менее, кальцификация и кистозные изменения могут присутствовать на ранней стадии эволюции опухоли. МРТ-исследования обычно показывают T1-hypodensity и T2-hyperintensity, с увеличением областей, вовлеченных в начале эволюции опухоли. Усиление гадолиния не распространено в низкодисперсных диффузных астроцитомах, но имеет тенденцию появляться во время прогрессирования опухоли.
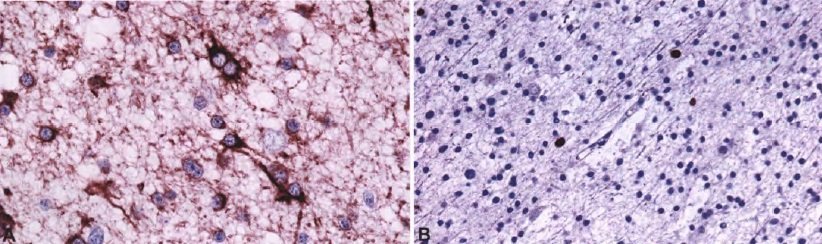
Диффузная астроцитома. A. Цитоплазма и клеточные процессы показывают различную степень иммунореактивности GFAP. B. Индекс пролиферации Ki-67 низок.
Макроскопическое исследование
Из-за их инфильтративной природы эти опухоли обычно проявляют размытость грубых анатомических границ. Наблюдается расширение и искажение (но не разрушение) анатомических структур, подвергшихся инвазии (например, коры головного мозга и компактных миелинизированных путей). Местные массовые поражения могут присутствовать либо в сером, либо в белом веществе, но они имеют нечеткие границы, и могут наблюдаться такие изменения, как меньшие или большие кисты, зернистые области и зоны устойчивости или размягчения. Кистозные изменения чаще всего проявляются в виде фокальной губчатой области с множественными кистами различных размеров. Обширное образование микроцист может вызвать студенистый внешний вид. Иногда имеется одна большая киста, заполненная прозрачной жидкостью. Опухоли с видными гемистоцитами иногда имеют одиночные крупные кисты с гладкой стенкой. Может также присутствовать фокальная кальцификация, и может наблюдаться более диффузная зернистость. Крайне редко наблюдается расширение в контралатеральные структуры, особенно в лобных долях.
Наличие некроза или микрососудистой пролиферации несовместимо с диагнозом диффузной астроцитомы. Фенотипически неопластические астроциты могут значительно варьироваться в зависимости от их размера, протуберантности и расположения клеточных процессов и обилия цитоплазматических глиальных волокон.
Картина может заметно различаться в разных регионах новообразования. Гистологическое распознавание неопластических астроцитов с использованием окрашивания H & E на срезе материала в основном зависит от ядерных характеристик. Нормальное астроцитическое ядро овальное до удлиненного, но при разрезании видны случайные круглые поперечные сечения. Ядро обычно везикулярное, с промежуточными массами хроматина и часто с отчетливым ядрышком. Нормальные человеческие астроциты не показывают H & Estainable цитоплазму, которая отлична от фонового нейропила. Реактивные астроциты определяются увеличенными ядрами и наличием окрашиваемой, определенной цитоплазмы, достигающей высшей точки в гемистоците, который имеет массу эозинофильной цитоплазмы, часто эксцентрическое ядро, и цитоплазму, которая распространяется на тонкие процессы.
Дифференциальная диагностика
Основным субъектом дифференциальной диагностики является реактивный астроцитоз. Поскольку большинство рассеянных астроцитомов с IDH-мутацией имеют мутации R132H, иммуногистохимия для R132H-мутантного IDH1 (иногда в сочетании с иммуногистохимией р53 и редко с оценкой трисомии 7) является мощным средством отличать неопластику от реактивных астроцитов. Однако в других ситуациях дифференциальная диагностика может быть сложной и может зависеть от стандартных гистологических различий. Диффузная астроцитома содержит астроциты, которые увеличиваются в количестве и обычно в размерах, но в противном случае трудно отличить на индивидуальной основе от нормальных или реактивных клеток. В незначительных степенях анаплазии именно количество астроцитов и (чаще всего) однородность их морфологии наиболее полезно для распознавания их неопластической природы.
Реактивные астроциты редко находятся в одной и той же стадии реактивности в одно и то же время, поэтому реакции показывают смеси астроцитов; Некоторые с увеличенными ядрами, другие с различным количеством цитоплазмы, чаще всего на несколько разреженном фоне. В диффузной астроцитоме почти все ядра выглядят одинаково, а фон имеет по крайней мере нормальную плотность или показывает увеличение числа клеточных процессов. Микрокистозное изменение может присутствовать, но большинство клеток имеют сходство друг с другом, без примеси гемистоцитов, чаще наблюдаемой в реакциях на повреждение. Существующие ранее типы клеток (например, нейроны) часто захватываются.
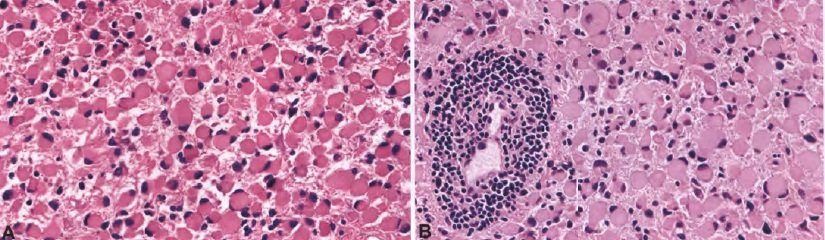
Гемоцитарная астроцитома. A. Опухолевые клетки имеют обильную эозинофильную цитоплазму, с ядрами, смещенными на периферию. B. Часто встречаются периваскулярные лимфоцитарные инфильтраты.
Интраоперационная диагностика
Техника мазка / сквош часто используется при стереотаксических биопсиях и дает аналогичные результаты, хотя этот метод крайне ненадежный для оценки клеточности. Многие гистологические признаки преувеличены и усилены (например, ядерные складки, аномальная структура хроматина и астроцитические процессы). Наличие многих округло-овальных ядер с гладким хроматином может указывать на наличие видимого олигодендроглиального компонента или (если ядра менее заметны) фонового белого вещества. Гистологически, могут быть значительные различия между опухолями и внутри одного и того же очага.
Рост
Фракция роста, определяемая индексом пролиферации Ki-67, обычно составляет <4%. Гемостоцитарные неопластические астроциты демонстрируют значительно меньшую скорость пролиферации, чем смешанный небольшой клеточный компонент. Однако микродиссекция выявляет идентичные мутации TP53 как в гемоцитах, так и в негемистоцитарных опухолевых клетках. Хотя сообщалось, что гемистоцитарный вариант может быть особенно подвержен прогрессированию к анапластической астроцитоме и глиобластоме, это не оправдывает общую классификацию как анапластическую астроцитому, и это впечатление не основано на современной молекулярной характеристике, в частности, на знании статуса мутации в IDH. Иммунофенотип Диффузные астроцитомы надежно экспрессируют GFAP, хотя и в разной степени, и не во всех опухолевых клетках. В частности, маленькие круглые клетки с скудной цитоплазмой и процессами, как правило, не жадно обозначают GFAP. В этих случаях иммуноположительность может быть ограничена небольшим перинуклеарным ободком и смешанными неопластическими клеточными процессами на фоне фибриллярного опухоли. Виментин, как правило, также является иммуноположительным, с характерной комбинацией, соответствующей GFAP.
Характерные молекулярные характеристики диффузной астроцитомы (см. Генетический профиль) часто можно продемонстрировать иммуногистохимически. Например, экспрессия мутанта R132H-IDH1 (мутация IDH1 R132H составляет около 90% всех мутаций, связанных с глиомой IDH) может быть обнаружена с использованием мутационно-специфического антитела. В мутантных опухолях все неопластические клетки обычно проявляют некоторую степень цитоплазматической (более сильной) и ядерной (более слабой) маркировки, если используемый препарат для окрашивания технически адекватен. По этой причине иммуногистохимия R132Hmutant IDH1 стала бесценным диагностическим дополнением не только в молекуле.
Имеющиеся данные свидетельствуют о том, что олигодендроглиомы с IDH-мутацией и 1p / 19q-кодовым кодом, диффузные астроцитомы с IDH-мутацией, анапластические астроцитомы с IDH-мутацией и с IDH-мутантными глиобластомами развиваются из отдельной популяции клеток-предшественников, которые отличаются от клеток-предшественников IDH- Глиобластома дикого типа. Генетический профиль Диффузные глиомы II и III классов ВОЗ, включая диффузную астроцитому, почти все характеризуются мутациями в IDH генах: либо IDH1, либо / DH2 {118,953, 1895,2810}. Диффузные глиомы, которые встречаются у взрослых и не содержат мутации в IDH, независимо от их сорта ВОЗ, как правило, проявляют более агрессивное клиническое поведение. Связанные с глиомой мутации IDH1 и IDH2 придают фенотип усиления функции соответствующим метаболическим ферментам IDH1 и IDH2, которые перепроизводят 2-гидроксиглутарат онметазолита. Физиологические последствия перепроизводства 2-гидроксиглутарата широко распространены, включая глубокие эффекты на клеточные эпигеномные состояния и генную регуляцию. В частности, мутации IDH индуцируют G-CIMP, благодаря чему широкое гиперметилирование в областях промотора гена подавляет экспрессию нескольких важных клеточных факторов дифференцировки.
Таким образом, считается, что мутации IDH и G-CIMP поддерживают глиомальные клетки происхождения в физиологических состояниях, подобных стволовым клеткам, по своей природе более склонным к самовосстановлению и онкогенезу. В частности, представляется, что мутации IDH способствуют образованию глиомы, нарушая хромосомную топологию и позволяя аберрантным хромосомным регуляторным взаимодействиям, которые индуцируют экспрессию онкогенов, включая онкогены глиомы, такие как PDGFRA. В соответствии с этой концепцией, мутации IDH, по-видимому, относятся к числу первых генетических изменений, происходящих в диффузной глиоме II степени ВОЗ. О метилировании промотора MGMT сообщалось примерно в 50% диффузных астроцитом в эпоху до IDH, но эта пропорция может быть выше среди диффузных астроцитом с мутантными IDH и не коррелирует с G-CIMP. Подавляющее большинство диффузных астроцитомов, связанных с IDH-мутантами, а также анапластические астроцитомы III степени и глиобластомы IV степени, которые развиваются из них, также обладают мутациями, определяющими классные мутации в TP53 и ATRX. ATRX кодирует важный связывающий хроматин белок, и его дефицит был связан с эпигеномной дисрегуляцией и дисфункцией теломер. В частности, мутации ATRX, по-видимому, вызывают аномальный механизм поддержания теломер, известный как альтернативное удлинение теломеров. Мутации ATRX и альтернативное удлинение теломер являются взаимоисключающими с активирующими мутациями в гене TERT, который кодирует каталитический компонент теломеразы.
Интересно, что мутации TERT обнаруживаются у подавляющего большинства олигодендроглиом и большинства глиобластомы IDH-дикого типа. Для патогенеза всех диффузных глиом необходимы, по-видимому, четкие механизмы поддержания теломеры, опосредуемые либо активированной теломеразой, либо альтернативное удлинение теломер. Недостаточность ATRX также ассоциировалась с генерализованной геномной нестабильностью, которая может вызывать p53-зависимую гибель клеток в некоторых контекстах. Таким образом, мутации TP53 в диффузной астроцитоме могут обеспечить выживаемость опухолевых клеток в условиях потери ATRX. Геномическая нестабильность диффузных астроцитом IDH-мутантов отражается в характерных аномалиях количества копий ДНК, которые включают в себя события усиления низкого уровня, включающие онкогены MYC и CCND2 во взаимоисключающих подмножествах. Копирование числовых событий, обычно связанных с глиобластомой IDH-дикого типа, таких как EGFR амплификация и гомозиготная делеция CDKN2A, встречается редко, подчеркивая биологические различия между IDH-мутантом и астроцитомами IDHwildtype. На основе профилирования экспрессии было обозначено множество подклассов рассеянной астроцитомы, стратифицированных статусом мутаций IDH, а также маркеров нейрогенных линий. Профили транскрипции диффузных астроцитом указывают на различные клетки происхождения в дополнение к специфическим геномным признакам.
Генетическая восприимчивость
Диффузная астроцитома может возникать у пациентов с наследственными мутантами зародышевой линии TP53 / синдром Ли-Фраумени (см. Синдром Ли-Фраумени, стр. 310), хотя у затронутых членов семьи чаще развивается анапластическая астроцитома и глиобластома. У пациентов с унаследованным эллиптическим энцефалопатическим синдромом, унаследованным от Оллиера, диагностирована астроцитома более низкого ранга, которая также предрасполагает пациентов к хондросаркоме.
Клинические прогностические факторы
В эпоху до IDH медианное время жизни, как сообщается, находилось в диапазоне 6-8 лет с выраженной индивидуальной вариацией. На общую продолжительность заболевания в основном влияет динамика злокачественной прогрессии, которая, как сообщается, происходит после медианного времени 4-5 лет. Исследования, проведенные Европейской организацией исследований и лечения рака (EORTC) 22844 и 22845, показали, что возраст пациента более 40 лет, гистологическая картина астроцитомы, самый большой диаметр опухоли> 6 см, опухоль, пересекающая срединную линию, и неврологический дефицит до операции были связаны с худшим исходом . Однако эти прогностические оценки необходимо переоценить в контексте статуса мутаций в IDH; Одно исследование, которое включало 683 случаев диффузной астроцитомы IDH мутантов из трех серий, показало медианную выживаемость в 10,9 лет.
Распространение
Низкие до отсутствующих скоростей пролиферации, как оценивается митотическим счетом или индексом пролиферации Ki-67, традиционно считались диагностическим критерием для классификации диффузной астроцитомы как второго сорта ВОЗ. Среди гистологически диагностированных диффузных астроцитом уровень пролиферации не был связан с исходом. Гистопатологические факторы. Гемистоцитарная астроцитома ассоциируется с ранним прогрессированием и низшим исходом, но отсутствуют данные о более крупных современных когортах пациентов с известным статусом мутаций в IDH.
Другие гистологические факторы, связанные с исходом, пока не выявлены.
Генетические изменения
Мутации IDH1 / 2 отличают астроцитомы с более благоприятным течением от опухолей IDH-дикого типа, которые имеют менее благоприятный ход. Среди опухолей IDHwildtype генотип усиления 7q и потеря 10q ассоциируется с особенно плохим исходом.
Однако, как отмечалось ранее (см. Клинические прогностические факторы), исследование, которое включало 683 диффузных астроцитомы из трех серий, показало медианную выживаемость в 10,9 лет. Мутации IDH могут быть полезны в качестве прогнозирующего биомаркера, когда становятся доступными IDH-методы лечения, такие как маломолекулярные ингибиторы или вакцины.
Всесторонние исследования генотипирования показали корреляцию между статусом мутаций IDH и другими молекулярными параметрами; В частности, существуют сильные ассоциации между мутацией IDH и мутацией TP53 (присутствуют в 94% случаев) и инактивацией ATRX (присутствуют в 86% случаев). Мутантный IDH катализирует образование 2-гидроксиглютарата, который может потенциально контролироваться с помощью MR-спектроскопии или в биологических жидкостях. Однако клиническая ценность этих подходов еще не подтверждена.