После отчета IARC 1994 года причинная роль инфекции H. pylori была подтверждена эпидемиологическими и экспериментальными данными. Исследования случай-контроль, изучающие связь инфекции H. pylori и диагностики рака желудка, дали несогласованные результаты. Такие несоответствия были результатом игнорирования временной взаимосвязи между инфекцией, начиная с детства, и клинического диагноза рака желудка несколько десятилетий спустя. Три отдельных когортных исследования, два в Соединенных Штатах (Гавайи и Калифорния) и один в Англии, оценивали антитела против Helicobacter в образцах сыворотки за несколько лет до клинической диагностики рака желудка (Forman et al., 1991; Nomura et al., 1991; Parsonnet Et al., 1997). Неоспоримая ассоциация помогла объяснить предыдущие противоречивые выводы. Было показано, что передовые предраковые поражения желудка, такие как обширная атрофия и кишечная метаплазия, не являются благоприятными нишами для колонизации H. pylori. Исследования в Японии показали, что риск рака желудка выше у пациентов с отрицательной серологией для инфекции H.pylori (вероятно, потерян), но выраженная атрофия желудка, отраженная в низких уровнях пепсиногена I (Ohata et al., 2004). Исследования по контролю над случаями, которые касаются вопроса о временности, показали, что риск рака желудка у более молодых пациентов и / или небольших опухолей имеет четкую связь с инфекцией H.pylori. Связь не наблюдалась у крупных опухолей или пожилых пациентов, что, вероятно, указывало на потерю многолетней инфекции, когда микроокружение желудка больше не благоприятствовало колонизации H. pylori (Fukuda et al., 1995).
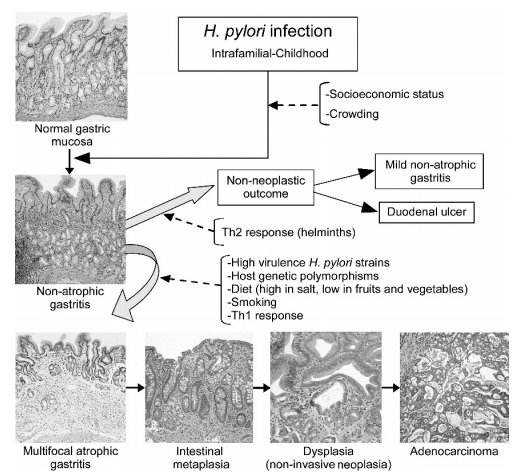
Диаграммное представление модели канцерогенеза желудка. Основной движущей силой является инфекция Helicobacter pylori. Взаимодействие нескольких факторов (человека, бактерий и окружающей среды) определяет тип гастрита, неатрофный, который не увеличивает риск рака желудка, или мультифокальный атрофический, который может представлять собой первый этап в канцерогенной последовательности желудка. (Воспроизводится и адаптировано из Correa et al., 2006, с разрешения.)
По оценкам, половина населения мира инфицирована H. pylori, но только небольшое меньшинство развивает рак желудка: примерно 3 на 10000 инфицированных субъектов в год (по оценкам авторов). Это уже давно признано 4 P. Correa et al. Что у пациентов с язвенной болезнью пептического двенадцатиперстной кишки, в большинстве случаев вызванных инфекцией H.pylori, повышен риск рака желудка (Hansson et al., 1996; Uemura et al., 2001). Но у пациентов с язвенной болезнью желудка, вызванных инфекцией H.pylori, повышенный риск развития рака (Hansson et al., 1996; Ogura et al., 2006). Язва двенадцатиперстной кишки обычно сопровождается длительным антральным преобладающим неатрофическим гастритом. Язва желудка, однако, является продолжением мультифокального атрофического гастрита. Похоже, что инфекция H.pylori является движущей силой канцерогенеза желудка. Но результат инфекции модулируется генетической восприимчивостью инфицированного человека и внешней среды. Представлено схематическое изображение модели канцерогенеза желудка. Множественные силы взаимодействуют и определяют, приведет ли инфекция к неатрофическому гастриту или мультифокальному атрофическому гастриту. Последнее является первым шагом в предраковых каскадах. Ниже приводится краткое описание основных этиологических сил.
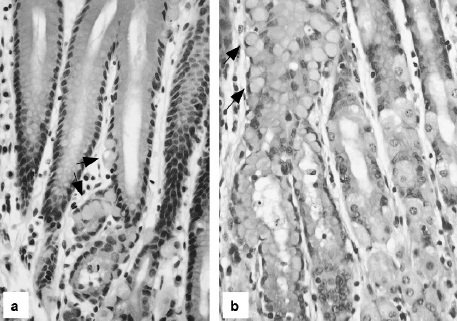
Сканирующая электронная микрофотография слизистой оболочки желудка, инфицированная Helicobacter pylori. Бактерии концентрируются на межклеточных соединениях. (Фотография любезно предоставлена доктором Франсиско Эрнандесом, Отделом электронной микроскопии, Коста-Рика.)
Бактериальный агент
В 2005 году Нобелевскую премию по медицине или физиологии присудили Робин Уоррен и Барри Маршалл за их пионерскую работу, связывающую инфекцию H.pylori с пептическими язвами и карциномой желудка. Спиральные бактерии ранее были описаны в слизистой оболочке желудка Giulio Bizzozero (Bizzozero 1892) в Павии за столетие до классических писем редактору Ланце Уорреном и Маршаллом (Warren and Marshall 1983). H. pylori колонизирует слизистую оболочку желудка и в основном локализуется внеклеточно. Тем не менее, недавно было показано, что бактерии могут найти свой путь к цитоплазме желудочных эпителиальных клеток и к основополагающим свойствам ламины (Dubois and Boren 2007, Necchi et al., 2007; Semino-Mora et al., 2003). Способность H. pylori индуцировать рак желудка связана с его вирулентностью, в значительной степени определяемой его цитотоксином CagA и вакуолирующим токсином VacA. CagA положительные и vacAs1m1 бактериальные генотипы были связаны с тяжелым гастритом, атрофией, кишечной метаплазией и раком желудка. CagA-негативные генотипы vacAs2m2 менее вирулентны, вызывают более мягкий, неатрофный тип гастрита и не всегда приводят к неопластическому исходу (Cittelly et al., 2002; Kato et al., 2006a; Quiroga et al., 2005; Tham et al. 2001). Белок CagA вводится в цитоплазму эпителиальной клетки системой секреции типа IV. После инъекции CagA фосфорилируется и начинает процесс, приводящий к изменениям в клеточной морфологии и иммунологическому ответу на инфекцию (Peek and Crabtree 2006).
Генетическая восприимчивость
Генетическая восприимчивость — еще одна важная детерминанта в канцерогенном процессе желудка. Семейная кластеризация наблюдается примерно в 10% случаев, а 1% -3% является наследственной. В последней группе хорошо охарактеризованный синдром, наследственный диффузный рак желудка, связан с мутациями зародышевой линии в гене эпителиального кадгерина (E-cadherin) примерно в 30% семей (Carneiro et al., 2007). Этот синдром изначально был описан Гилфордом и его коллегами в 1998 году в трех новозеландских семьях маори с ранним диффузным раком желудка (Guilford et al., 1998). С тех пор в разных странах сообщается по меньшей мере 151 семья (Carneiro et al., 2007; Kaurah et al., 2007; MedinaFranco et al., 2007a). Автосомальная доминантная мутация с пенетрантностью 70% приводит к смерти от рака желудка в раннем возрасте.
Помимо описанного синдрома, большое количество доказательств демонстрирует влияние генетических вариантов риска рака желудка как часть многофакторной этиологии спорадических случаев. Генетическими вариантами, которые получили больше внимания, являются те, которые находятся в генах, кодирующих про- и противовоспалительные цитокины, участвующие в реакции против инфекции H.pylori. На основании двух недавних обзоров (Gonzalez et al., 2002; Hamajima et al., 2006) и некоторых оригинальных статей (Camargo et al., 2006; Goto et al., 2006; Hou et al., 2007; Jin et al., 2007a, 2007b; Kaise Et al., 2007; Kamangar et al., 2006; Kato et al., 2006a; Larsson et al., 2006; Lee et al., 2005; Liu et al., 2006; Lu et al., 2005a, 2005b; Medina-Franco et al., 2007b , Pinto-Correia et al., 2006; Savage et al., 2004; Sicinschi et al., 2006; Silva et al., 2001; Silva et al., 2003; Tang et al., 2007; Tatemichi et al., 2005; Wang et al., 2007a , 2007b, Zhou et al., 2007; Zintzaras 2006), краткое изложение основных полиморфизмов, изучаемых для ассоциации с диффузными и кишечными типами рака желудка, представлено в таблице. Генетические варианты сгруппированы в соответствии с процессами, связанными с канцерогенезом, в котором их кодированные белки вмешиваются. Биологические механизмы, которые объясняют прямые и обратные ассоциации между этими полиморфизмами и риском развития рака желудка, требуют дальнейшего изучения. Включение взаимодействия генов и генов и окружающей среды в будущие исследования ассоциации может выявить сложную этиологию этой неоплазии. Рекомендуется рекомендовать изучение этнической специфики из-за документированного дифференциального распределения генетических вариантов среди этнических групп (Hassan et al., 2003; Zabaleta et al., 2008). Некоторые метаанализы показали, что маркеры риска специфичны по этническому признаку (Camargo et al., 2006; Zintzaras 2006).

Внешняя среда
Несколько эпидемиологических исследований рака желудка, проведенных до признания роли инфекции H. pylori, выявили несколько факторов экологического риска. Было показано, что две диетические модальности влияют на риск развития рака у разных популяций. Первый был основан на наблюдении, что во всех популяциях с высоким риском развития рака потребление соли было очень высоким. Линейная корреляция между потреблением соли и риском развития рака желудка была широко продемонстрирована (Joossens et al., 1996; Tsugane 2005). Второе замечание было предоставлено в основном исследованиями случай-контроль, показывающими защитный эффект адекватного потребления свежих фруктов и овощей. Этот эффект впервые был представлен Хираямой в Японии (Хираяма, 1986 г.), а затем подтвержден во многих разных странах, как описано Block and al. (1992) и недавно другими (Lunet et al., 2007; Tsugane and Sasazuki 2007).
Сокращения: TFF: трефоиловые пептиды; TNF: фактор некроза опухоли; COX2: циклооксигеназа 2; INOS: индуцибельная синтаза оксида азота; IFNGR2: интерфероновый гамма-рецептор 2; GST: глутатион-S-трансфераза; NAT: N-ацетилтрансфераза; MTHFR: 5,10-метилентетрагидрофолатредуктаза; MTHFD: метилентетрагидрофолатдегидрогеназа; XRCC1: кросс-дополняющая группа рентгеновских лучей 1; OGG1: 7,8-дигидро-8-оксогуанин-ДНК-гликозилаза; TP53: опухолевый белок 53; PGC: пепсиноген C; CDH1: E-cadherin; EGF: эпидермальный фактор роста; TGFB: трансформация фактора роста бета; TGFBR2: рецептор TGFB II.
Хотя социально-экономический статус не является причинным фактором риска, он суррогат других переменных, которые были обратно связаны с риском развития рака желудка, таких как санитарные условия и питание. Социально-экономический статус определяет возраст и распространенность инфекции H. pylori. Предыдущие исследования показали, что высокая распространенность, наблюдаемая в развивающихся странах, связана с переполнением семьи в детском возрасте и очевидной передачей от более старших и младших братьев и сестер (Goodman and Correa 2000). Другим внешним фактором окружающей среды является курение (IARC 2002, Nishino et al., 2006). Табак содержит широкий спектр канцерогенов, включая N-нитрозосоединения, которые были связаны с канцерогенезом желудка (Mirvish 1995). Наконец, сопутствующие заболевания также могут определять риск рака желудка. Известно, что сопутствующая инфекция гельминтами может смещать общий иммунный ответ Th1-типа против H.pylori на менее вредный ответ типа Th2 и уменьшать развитие атрофии желудка (Whary and Fox 2004; Whary et al., 2005). Эти результаты свидетельствуют о возможной роли гельминтов в профилактике развития рака.