Большая часть информации описывает клеточное взаимодействие местных анестетиков, исследуемое на изолированном нерве in vitro. Хотя эти знания применимы к клиническим ситуациям в общем, в фармакологии местных анестетиков in vivo есть важные отличия. Например, минимальная блокирующая концентрация лидокаина на изолированном нерве in vitro составляет 0,07%. Блокада же нерва требует концентраций от 1,5 до 2%, что приблизительно в 30 раз выше.
Большинство отличий фармакологии местных анестетиков in vitro и in vivo могут быть отнесены к различиям в фармакокинетике. В отличие от ситуации in vitro, in vivo есть ряд конкурентных точек связывания местных анестетиков (и соответственно прекращения их действия), кроме тех, что расположены внутри нерва. Например, препарат может быть выведен в плазму или лимфу, может секвестрироваться в мышце или жире, может неспецифически связываться с соединительной тканью и т. д.
Факторы, определяющие развитие блокады
А. Место инъекции. Вероятно, наиболее важным фактором, определяющим скорость развития блокады, является близость места инъекции к целевому нерву/нервам. Чем ближе к нерву введен местный анестетик, тем меньше времени требуется на его диффузию из места инъекции к цели.
1. Нейрональные барьеры. Даже если местный анестетик введен непосредственно к нерву, прежде чем препарат достигнет аксона, ему необходимо пройти через множество тканевых барьеров (например, эпиневрий, периневрий, эндоневрий, жир). Какие физико-химические свойства местных анестетиков этим управляют и как быстро это происходит — неизвестно. Неизвестно также, служит ли распределение гидрофобных препаратов в нейрональный жир резервуаром препарата и, таким образом, удлиняет блокаду, или служит ловушкой для препарата, снижающей доступ местного анестетика к аксонам.
Б. Доза, объем и концентрация. Хотя результаты до некоторой степени варьируют в зависимости от типа блокады и используемого местного анестетика, в целом скорость развития, глубину и длительность блокады нерва определяет общая доза местного анестетика, а не его объем или концентрация.
В. Выбор местного анестетика. Местные анестетики должны проходить через водянистое внеклеточное жидкостное пространство, чтобы попасть от места инъекции до необходимого нерва. По пути гидрофобные местные анестетики с большей вероятностью перейдут из гидрофильного внеклеточного жидкостного пространства в окружающие ткани или неспецифично свяжутся с гидрофобными зонами соединительной ткани, чем более гидрофильные препараты. Это, по-видимому, объясняет более медленное развитие действия гидрофобных местных анестетиков, несмотря на свойственную им более высокую мощность.
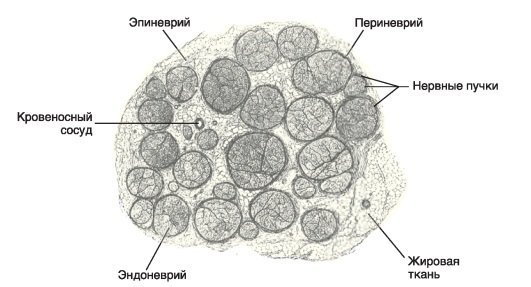
Поперечный срез периферического нерва человека. Аксоны собраны в пучки, содержащие от десятков до сотен и более аксонов. Каждый отдельный аксон в пучке окружен рыхлой соединительной тканью (эндоневрием). Каждый пучок окружен пери-неврием, и набор пучков, образующий отдельный нерв, окружен эпиневрием. Перинев-рий и эпиневрий представляют собой более прочные барьеры, чем эндоневрий
Факторы, определяющие длительность действия
Длительность блокады в основном является функцией скорости выведения препарата.
А. Доза. Более высокие дозы местных анестетиков продуцируют более длительную блокаду, чем меньшие дозы, потому что требуется больше времени для их выведения из нерва/окружающих тканей достаточного для снижения концентрации ниже минимума, необходимого для блокады.
Б. Выбор местного анестетика. В целом гидрофобные местные анестетики выводятся из места введения медленнее, чем гидрофильные, по причинам, изложенным выше. Кроме того, гидрофобные препараты обладают большей мощностью, чем гидрофильные. Следовательно, гидрофобные местные анестетики вызывают более длительную блокаду, чем гидрофильные.
1. Сосудистые эффекты. Местные анестетики оказывают сложное и вариабельное влияние на местные кровеносные сосуды и, следовательно, на свое собственное выведение. В общем, в высоких концентрациях местные анестетики склонны вызывать вазодилатацию, тем самым повышая местный кровоток и, следовательно, свое собственное выведение. По мере снижения концентрации местного анестетика, либо в связи с удаленностью от места инъекции, либо в связи с выведением, развивается вазоконстрикция, снижающая выведение и увеличивающая длительность действия (индивидуальные различия специфических препаратов см. в тексте ниже).
Добавки
Множество «добавок» используют с местными анестетиками для изменения скорости развития эффекта или длительности. Вот наиболее типичные:
А. Вазоконстрикторы
1. Добавление к местному анестетику адреналина снижает местный кровоток и, следовательно, выведение препарата, таким образом увеличивая длительность блокады и снижая пиковую концентрацию местного анестетика в плазме после спинальной, эпидуральной или периферических блокад нервов. Более низкая пиковая концентрация в плазме снижает риск токсического действия на центральную нервную систему (ЦНС) в результате системной абсорбции и повышает дозу местного анестетика, которую можно применить безопасно. Важно помнить, что адреналин не обеспечивает защиту от токсического эффекта при случайном введении местного анестетика в сосуд.
а. Эффект адреналина в общем выше для более коротко действующих, более гидрофильных препаратов.
б. Чаще всего адреналин добавляют к местному анестетику в концентрации 5 мкг/мл. Для того чтобы считать эту концентрацию оптимальной для всех местных анестетиков, имеющихся данных недостаточно.
в. Было показано, что добавление адреналина к 2-хлоропрокаину для спинальной анестезии вызывает «гриппоподобные» симптомы (недомогание, миалгия, артралгия, анорексия) по неизвестным причинам. При использовании чистого 2-хлоропрокаина для спинальной анестезии или добавления адреналина к другим местным анестетикам для спинальной анестезии этой симптоматики не возникает. Следовательно, адреналин к 2-хлоропрокаину для спинальной анестезии добавлять не следует. Добавление фентанила (20 мкг) к 2-хлоропрокаину является разумной альтернативой и эффективно удлиняет сенсорный спинальный блок.
2. Фенилэфрин (мезатон) также добавляют к местным анестетикам для спинальной анестезии. Обычная доза составляет 1—2 мг (мощность 1 мг фенилэфрина эквивалентна 0,1 мг адреналина). Однако системная абсорбция и последующие гемодинамические эффекты при использовании в растворах для эпидуральной или периферических блокад ограничивают его применение.
Б. Клонидин
1. а2-Адренергические агонисты относятся к анальгетикам; было доказано, что они ингибируют как С-волокна, так и А-волокна и умеренно ингибируют выведение местных анестетиков. При добавлении к местным анестетикам клонидин удлиняет сенсорный блок во время периферической, центральной нейроаксиальной и внутривенной региональной анестезии до степени, сравнимой с той, которую вызывает адреналин. Однако, в отличие от адреналина, клонидин не удлиняет моторный блок. Интересно, что пероральное назначение клонидина удлиняет спинальный блок так же эффективно, как и добавление к местному анестетику, вводимому интратекально.
2. Применение клонидина ограничено побочными эффектами, в первую очередь седацией, гипотензией и брадикардией. Эти побочные эффекты возникают вследствие того, что пресинаптические а2-адренерги- ческие рецепторы ингибируют выброс норадреналина из норадренер- гических нейронов в ЦНС.
В. Бикарбонат. Натрия бикарбонат (1 мЭкв/мл) иногда добавляют к местному анестетику для увеличения скорости развития эффекта. Однако данные относительно эффективности бикарбоната для этой цели противоречивы. В целом, бикарбонат не ускоряет действие гидрофобных местных анестетиков (например, бупивакаина, этидокаина), и было показано, что позитивный эффект для гидрофильных препаратов чаще наблюдается при эпидуральной блокаде, чем при блокаде периферического нерва. Даже в тех исследованиях, которые показали ускорение развития действия при добавлении бикарбоната, эффект не велик, и в большинстве случаев клиническое его значение вызывает вопросы (например, на приготовление и добавление бикарбоната может уйти больше времени, чем на развитие эффекта). При добавлении бикарбоната к местному анестетику необходима осторожность, чтобы не добавить слишком много (т. е. не сделать раствор слишком щелочным) во избежание преципитации местного анестетика. Обычно рекомендуется добавлять 1 мЭкв бикарбоната на каждые 10 мл лидокаина или мепивакаина и одну десятую количества бупивакаина — если добавлять вообще.
Г. Гиалуронидаза. Этот фермент разрушает гиалуроновую кислоту, важный компонент соединительной ткани. Его добавляют к местным анестетикам с целью разрушения соединительной ткани во внеклеточном матриксе, таким образом усиливая дисперсию препарата через эти ткани. Клинические преимущества методики остаются под вопросом, и в регионарной анестезии она практически не применяется, за исключением перибуль- барных блокад. При перибульбарной анестезии применение гиалурони- дазы сопровождается ускорением развития моторного блока, но он также упоминается в сообщениях о клинических случаях как причина аллергических реакций и повреждения экстраокулярных мышц.
Д. Опиоиды
1. При добавлении к местным анестетикам короткого действия для спинальной анестезии, опиоиды короткого действия (например, фентанил, суфентанил) удлиняют и усиливают сенсорный блок без удлинения моторного блока или времени действия, что особенно полезно при спинальной анестезии в амбулаторной практике. Однако проблемой может быть возникающий зуд. При добавлении к местным анестетикам для блокады периферических нервов было показано, что фентанил удлиняет сенсорный блок, но по некоторым исследованиям ценой значительного замедления развития действия.
2. При добавлении к местным анестетикам опиоидов нельзя забывать об их системных/побочных эффектах. Например, при добавлении к местным анестетикам для эпидуральной инфузии фентанил усиливает анальгезию за счет системного действия и перераспределения в ствол мозга, со всеми опасностями, присущими системному применению опиоидов. Аналогично, при добавлении к местным анестетикам для интратекального введения пиковая плазменная концентрация приходится на интервал между 20 и 30 мин и превышает необходимую для послеоперационной анальгезии. Это объясняет множество сообщений о «ранней» респираторной депрессии у матерей и фетальных нарушениях сердечного ритма у младенцев при добавлении суфентанила к местным анестетикам для интратекальной анальгезии родов или кесарева сечения.
Дифференциальный блок
В клиническом значении термин дифференциальный блок описывает явление, при котором некоторые функции нерва блокируются быстрее других. Он, вероятно, отличается от феномена, имеющего место in vitro, где различные классы нервных волокон блокируются различными концентрациями местного анестетика.
A. В целом, автономная функция, болевая, тактильная и температурная чувствительность (особенно холодовая) блокируются раньше, чем проприоцептивная, глубокого давления и моторная функция.
Б. Традиционно этот феномен считался следствием того, что некоторые типы нервов обладают более высокой чувствительностью к блокаде местными анестетиками. Однако это объяснение не согласуется с исследованиями in vitro, показывающими, что С-волокна (симпатическая, болевая, температурная функции) более устойчивы к местным анестетикам, чем А5-волокна (моторные нейроны).
B. Механизм, лежащий в основе дифференциального блока in vivo, все еще не известен, но может включать длину участка нерва, на который воздействовал местный анестетик, положение рассматриваемого аксона в нервном пучке, частоту проводимых импульсов, взаимодействие с частотным паттерном пучка (который играет роль в кодировании сенсорной информации, передаваемой в центр), и так далее.
Г. Дифференциальная блокада более заметна у некоторых местных анестетиков и манифестирует блокадой сенсорного проведения с очевидным отставанием моторной блокады при более низких концентрациях препарата. Такая сенсорно-моторная диссоциация считается полезной для послеоперационной анальгезии.
Эффект мантии
Кроме дифференциальной блокады нерва, вызывающей временные различия в последовательности блокирования разных видов чувствительности и функций, есть пространственные различия в развитии блокады. При блокаде нервов, иннервирующих конечность, часто можно видеть, что более проксимальные части конечности (т. е. расположенные ближе к месту инъекции местного анестетика) блокируются ранее более дистальных зон. Этот феномен считается следствием расположения аксонов внутри нервного пучка, когда нервы, иннервирующие дистальные части конечности, лежат в сердцевине пучка, тогда как другие — в мантии. Поскольку местные анестетики продвигаются центрипетально — от наружных слоев нерва к сердцевине, волокна мантии блокируются первыми.
Местные анестетики
A. Кокаин. Кокаин был первым местным анестетиком, примененным в медицине. Как от местного анестетика для периферических и центральных нейроаксиальных блокад от него отказались в связи с нейротоксичностью и опасностью злоупотреблений.
1. Кокаин относится к местным анестетикам-эфирам, которые метабо- лизируются в печени с образованием активных метаболитов. Время полувыведения у людей составляет приблизительно 45 мин. В присутствии алкоголя метаболический путь изменяется с образованием ко- каэтилена, еще более токсичного, чем кокаин.
2. В настоящее время единственное применение кокаина в медицине — для местной топической анестезии (в виде 4%-го раствора) в хирургии уха, горла и носа (ЛОР), поскольку он вызывает выраженную вазокон- стрикцию (таким образом уменьшая кровоточивость) в дополнение к сенсорному блоку.
3. Максимальная доза кокаина составляет 200 мг и, поскольку токсичность местного анестетика аддитивна, на практике, для интубации трахеи без выключения сознания, обычно выполняют топическую аппликацию кокаина в нос с последующим введением свободного количества лидокаина (4%-го) или бензокаина в виде спрея в глотку/тра- хею для снижения риска системной токсичности.
4. Кокаин может вызывать спазм коронарных артерий. Описан случай острого инфаркта миокарда у не имевшего факторов кардиального риска 23-летнего пациента во время риносептопластики с анестезией кокаином и фенилэфрином.
Б. Бензокаин. Бензокаин был первым синтетическим местным анестетиком (хотя первым синтетическим местным анестетиком, примененным клинически для блокад нервов, был прокаин).
1. Представляет собой эфир и вторичный амин с рКй 3,5. Следовательно, бензокаин существует только в незаряженной форме при физиологическом pH и плохо растворим в водных растворах.
2. В связи с плохой растворимостью в воде, бензокаин используют исключительно как топический спрей, рассасывающиеся пастилки или таблетки для слизистых оболочек или кожных кремов или гелей для дермальной гипостезии.
3. Хотя свойством вызывать ту или иную степень метгемоглобинэмии обладает большинство местных анестетиков, риск применения бензокаина в этом отношении особенно высок. Способность вызывать метгемоглобинэмию усугубляется тем, что его относительно просто передозировать, поскольку количественно определить содержание препарата в спрее или креме трудно.
B. Прокаин. Прокаин это эфир и первый синтетический местный анестетик, примененным клинически.
1. Прокаин быстро метаболизируется в плазме холинэстеразой и время его полувыведения составляет менее 8 мин, в связи с чем риск его системной токсичности невысок.
2. Прокаин применяют главным образом для подкожной инфильтрации (0,25—1,0%-й). Он неэффективен при топическом применении и ненадежен для эпидуральной блокады. Это не лучший выбор для блокады периферических нервов из-за медленного развития и короткого времени действия.
3. Прокаинприменяютдляспинальнойанестезии (50—100мг). При сравнении с лидокаином, вызываемая им блокада несколько короче, а частота неудачных блокад выше (неадекватный сенсорный блок), но значительно ниже частота транзиторной неврологической симптоматики (ТНС). Коммерчески доступный 10%-й раствор необходимо разводить до 5%-го в декстрозе, воде, физиологическом растворе или спинномозговой жидкости (СМЖ).
4. Как и все синтетические местные анестетики-эфиры, прокаин метаболизируется до пара-аминобензойной кислоты, молекулу которой часто ассоциируют с аллергическими реакциями.
Г. Тетракаин. Местный анестетик-эфир с самым длительным действием.
До открытия местных анестетиков-амидов был наиболее предпочтительным препаратом для длительных блокад.
1. Как и у прокаина, медленное развитие действия при блокаде периферического нерва или эпидуральной анестезии стало причиной отказа от его применения при появлении альтернативы в виде амидов.
а. Одно время тетракаин смешивали с более «быстрыми» местными анестетиками (например, с хлоропрокаином), пытаясь — в конечном итоге безуспешно — ускорить развитие его действия при со- хранениидлительности.
2. Тетракаин метаболизируется (гидролизируется) медленнее, чем прокаин (хотя быстрее, чем местные анестетики-амиды), следовательно, его риск системной токсичности выше.
3. Тетракаин применяют главным образом для спинальной анестезии в виде 1%-го раствора и порошка («нифаноидные кристаллы»), которые можно развести СМЖ, водой, физиологическим раствором или декстрозой.
а. Тетракаин в сочетании с фенилэфрином (5 мг) или адреналином (0,2 мг) обеспечивают самый длительный блок (4—6 ч).
4. Тетракаин очень эффективен для анастезии слизистых оболочек (для этой цели он доступен в комбинации с бензокаином) и применяется для топической анестезии в офтальмологии.
Д. 2-Хлоропрокаин. 2-Хлоропрокаин, производное прокаина, стал последним местным анестетиком-эфиром, введенным в клиническую практику.
1. В отличие от прокаина, действие 2-хлоропрокаина развивается быстро, и концентрации от 2 до 3% эффективны для эпидуральной и спинальной анестезии, а также для периферических блокад. Поскольку действует он от 30 до 60 мин, то удобен для коротких амбулаторных операций.
2. 2-Хлоропрокаин гидролизируется в плазме еще быстрее, чем прокаин, и его время полувыведения всего 1 мин. Следовательно, риск системной токсичности ниже, чем у любого другого местного анестетика.
а. Низкий риск токсичности для матери и новорожденного и быстрое развитие действия делают хлоропрокаин привлекательным препаратом для эпидуральной анестезии при кесаревом сечении.
3. Составы. Хлоропрокаин коммерчески доступен в виде раствора без консерванта и раствора, содержащего натрия бисульфит в качестве антиоксиданта. Учитывая потенциальную опасность нейротоксичности, для центральных нейроаксиальных блокад следует использовать только растворы без консерванта.
4. Применение хлоропрокаина для спинальной анестезии противоречив. Интратекальное введение 2%-го хлоропрокаина в дозе 40 мг вызывает хорошую спинальную анестезию с быстрым восстановлением; ТНС встречается реже, чем при использовании лидокаина.
5. Интересно, что при использовании 2-хлоропрокаина для эпидуральной анестезии было отмечено последующее снижение длительности анальгетического действия эпидурально вводимых морфина, фентанила и клонидина. Механизм неизвестен.
Е. Лидокаин. Лидокаин стал первым местным анестетиком-амидом, введенным в клиническую практику и быстро вытеснившим эфиры благодаря своему более длительному действию и более высокому качеству блокады, чем у прокаина, более низкой токсичности, чем у тетракаина, и значительно меньшему риску аллергии. Это «архетип» местного анестетика- амида, с которым сравнивают все остальные амиды.
1. Лидокаин эффективен для блокад периферических нервов (1 и 1,5%-й), эпидуральной анестезии (2%-й), спинальной анестезии (0,2-5%-й), внутривенной регионарной анестезии (0,5%-й) и анестезии слизистых (4%-й).
2. Лидокаин вызывает умеренную вазодилатацию.
3. Лидокаин с наибольшей среди местных анестетиков вероятностью вызывает ТНС, и хотя все местные анестетики могут вызвать повреждение спинного мозга, он вполне может считаться одним из самых опасных препаратов в этом отношении.
4. Есть сообщения и об аллергических реакциях на лидокаин, хотя и очень немногочисленные.
Ж. Мепивакаин. Мепивакаин — это циклический третичный амин, как ро- пивакаин и бупивакаин, но клинически больше похожий на лидокаин. Химически он отличается от ропивакаина и бупивакаина наличием метальной группы, заменяющей третичный азот.
1. Мепивакаин полезен для инфильтрационной, эпидуральной, спинальной анестезии, блокад периферических нервов. Не очень эффективен при использовании топически.
2. Мепивакаин вызывает умеренную вазоконстрикцию, что может объяснять его почти на 25% более длительное действие, чем у лидокаина.
3. Мепивакаин плохо метаболизируется у плода и новорожденного и, вероятно, не служит лучшим выбором для эпидуральной анестезии/анальгезии в акушерстве.
3. Прилокаин. Прилокаин клинически похож на лидокаин, и хотя в Соединенных Штатах для региональной анестезии, он коммерчески недоступен, в других странах его используют.
1. Прилокаин имеет большой объем распределения и метаболизируется быстрее всех местных анестетиков-амидов. Эти фармакокинетические свойства заставили некоторых считать его идеальным препаратом для внутривенной регионарной анестезии.
2. Прилокаин входит в состав местноанестезирующих кремов для кожной анестезии.
3. Уникальный метаболит прилокаина, о-толуидин, вызывает метгемо- глобинемию, которая ограничила клиническое применение прилокаина.
И. Бупивакаин. Бупивакаин стал первым длительно действующим местным анестетиком-амидом. У него есть бутильная группа у третичного атома азота, где у мепивакаина расположена метильная группа. Эта замена делает бупивакаин значительно более гидрофобным, чем мепивакаин (и лидокаин), его действие развивается медленнее, но значительно более длительно.
1. Бупивакаин применяют для инфильтрационной (0,25%-й), спинальной (0,5 и 0,75%-й), эпидуральной (0,5 и 0,75%-й) анестезии и блокад периферических нервов (0,375—0,5%-й). Он менее желателен для внутривенной регионарной анестезии в связи с его кардиотоксичностью. Блокады периферических нервов бупивакаином часто обеспечивают сенсорный блок на 4—12 ч, а иногда и до 12 ч. Это делает его полезным препаратом для амбулаторной регионарной анестезии конечностей, когда длительная анальгезия желательна. Интраперитонеальная инстилляция бупивакаина обеспечивает эффективную анальгезию после лапароскопическойхирургии.
2. В эпидуральном пространстве разведенные растворы бупивакаина (0,1%-й или менее) обеспечивают хорошую сенсорную анальгезию с незначительным моторным блоком или совсем без него. Это сделало его популярным для эпидуральной анальгезии родов и в послеоперационном периоде.
3. У бупивакаина, как и у других гидрофобных амидов, более низкий терапевтический индекс в отношении сердечно-сосудистой токсичности, чем у лидокаина. Высокие концентрации в плазме, способные вызвать признаки сердечно-сосудистой токсичности, обычно ассоциируются с внутрисосудистым введением. Поскольку бупивакаин абсорбируется в плазму медленнее, чем лидокаин, пик его плазменной концентрации приблизительно на 40% ниже (мг/мл на 100 мг введенных). Таким образом, вероятность системной токсичности у бупивакаина ниже, чем улидокаина, — если исключено внутрисосудистое введение.
К. Левобупивакаин. Бупивакаин существует в виде двух энантомеров, (R) и (S). коммерчески доступный бупивакаин является рацемической смесью обоих энантомеров, тогда как левобупивакаин — чистый (8)-энантомер. В США он в настоящее время недоступен.
1. Действие левобупивакаина приблизительно равно действию рацемической смеси (т. е. бупивакаину) в отношении его применения в региональной анестезии.
2. Исследования на людях-добровольцах и на животных указывают на то, что токсичность левобупивакаина для ЦНС и сердечно-сосудистой системы меньше, чем у бупивакаина. С практической точки зрения, это означает, что пациенты смогут переносить несколько более высокие дозы левобупивакаина до развития сердечно-сосудистого коллапса. Тем не менее левобупивакаин все же вполне кардиотоксичен, если достаточная его доза попадет внутривенно, и необходимо принимать все меры во избежание этого (тест-доза, дробное введение). По мнению Mather и Chang, левобупивакаин можно рассматривать как более безопасный, но нельзя рассматривать как безопасный.
Л. Ропивакаин. Ропивакаин — часть гомологичной серии, включающей бупивакаин и мепивакаин. Изопропильная группа ропивакаина связана с третичным азотом в положении метильной группы бупивакаина и бутильной группы бупивакаина. Как и левобупивакаин, он поставляется как отдельный энантомер. Доступен в виде 0,2, 0,5, 0,75 и 1%-го растворов.
1. Мощность ропивакаина клинически эквивалентна таковой у бупивакаина. Однако это, по-видимому, сильно упрощенная точка зрения. В действительности, относительная мощность этих двух препаратов различается в зависимости от изучаемой системы. Casati с авторами продемонстрировали, что ED50 доза для блокады бедренного нерва для ропивакаина и бупивакаина была одинаковой. В противоположность этому, в других исследованиях ропивакаин был на 40% слабее бупивакаина при использовании разведенного раствора для эпидуральной анальгезии родов. Аналогичным образом продемонстрировано, что ропивакаин был приблизительно на 35% слабее бупивакаина при интратекальном введении для анальгезии родов. Кроме того, в исследованиях, сравнивающих эти два препарата при блокаде периферического нерва, в основном было установлено, что эквивалентные дозы продуцируют одинаковые скорость развития действия и качество блока, но бупивакаин действовал значительно длительнее. Таким образом, ропивакаин, вероятно, не эквипотенциален бупивакаину «миллиграмм к миллиграмму», по крайней мере не во всех клинических ситуациях. Это следует иметь в виду при сравнении препаратов в отношении «мотор-спарринг» эффектов и кардиотоксичности.
2. Ропивакаин заметно менее кардиотоксичен, чем бупивакаин при сравнении «миллиграмм к миллиграмму». Тем не менее при сравнении эквипотенциальных доз различия в токсичности менее очевидны. Поэтому, как и с левобупивакаином, ропивакаин нельзя рассматривать как «безопасный» местный анестетик, независимо от того, «безопаснее» он бупивакаина или нет.
3. Как и кардиотоксичность, миотоксичность ропивакаина слабее, чем у бупивакаина «миллиграмм к миллиграмму». Неясно, так ли это при сравнении эквипотенциальных доз.
4. Ропивакаин вызывает вазоконстрикцию в концентрациях, применяемых клинически для блокад нервов. Это, вероятно, объясняет почему адреналин оказывает слабый эффект на длительность действия ропивакаина при эпидуральной блокаде и блокаде периферических нервов.
М. Этидокаин. Этидокаин — производное от лидокаина с дополнительной этильной группой на промежуточной цепочке и более длинной алифатической группой в третичном амине. Эти химические различия делают этидокаин очень гидрофобным местным анестетиком. Коммерчески он доступен за пределами США в виде 1,1,5 или 2%-го раствора.
1. Скорость развития действия этидокаина аналогична таковой у лидокаина, но его длительность сравнима с бупивакаином.
2. Клиническая мощность этидокаина аналогична таковой у мепивакаина в 1,5%-м растворе, обычно используемом для эпидурального пространства, и 1%-м растворе, используемом для блокад периферических нервов.
3. Этидокаин — единственный местный анестетик, блокирующий во время спинальной анестезии передачу в дорсальной колонне спинного мозга. Заманчиво отнести это на счет его более высокой жирорастворимости, ведущей к более экстенсивному проникновению в миелин оболочек нейронов дорсальной колонны.
4. Этидокаин вышел из клинического предпочтения в связи с тенденцией вызывать моторный блок, длящийся более сенсорного блока (отсутствие «сенсорно-моторной» диссоциации).
Н. Артикаин. Артикаин интересен структурой, в которой на месте бензольного кольца стоит 5-членное тиофеновое кольцо, как «гидрофобный хвост». Классифицируется как амид, поскольку тиофеновое кольцо соединено с промежуточной цепочкой амидной связкой, но у него есть также эфирная сторона цепочки, соединенная с тиофеновым кольцом.
1. Артикаин (4%-й) применяется «исключительно» как местный анестетик в стоматологии, второй из наиболее часто применяемых в этой области в США с момента его внедрения в клиническую практику в 2000 г. Его популярность связана с быстрым развитием действия, его длительностью и отсутствием риска аллергии, связанного с эфирами.
Смеси местных анестетиков
До открытия современных местных анестетиков-амидов была широко распространена практика смешивания эфира быстрого, но короткого действия (например, прокаин) с препаратом, действующим медленно, но долго (например, тетракаин). Целью было получение раствора, который действует быстро и долго. Смешивание анестетиков для этой цели все еще практикуется, в основном хирургами. Однако ценность такой методики в лучшем случае спорна. Во-первых, токсичность местных анестетиков аддитивна, в связи с чем общую дозу каждого анестетика необходимо уменьшить при смешивании на половину. Таким образом, общее число «быстро действующих» и «долго действующих» молекул местного анестетика, присутствующих в месте инъекции, будет равно половине того, что было бы, если бы препарат использовали в чистом виде. Следовательно, действие будет развиваться медленнее, чем это бывает у «быстро действующего» препарата, и короче, чем у «долго действующего». Например, смешивание хлоропрокаина с бупивакаином даст смесь по скорости и длительности сопоставимую с лидокаином. Таким образом, практику смешивания местных анестетиков, по-видимому, следует оставить истории.
Препараты местных анестетиков с депо-эффектом
Потенциальные преимущества длительно действующих местноанестезирующих блокад без нужды в катетерах и дозаторах породили попытки создания препаратов с депо-эффектом на основе в настоящее время применяемых местных анестетиков.
А. Эксперименты на животных показали способность различных препаратов, включая гели, липосомы, полимерные микросферы и водномасляные эмульсии вызывать длительно действующие местноанестезирующие блокады. К настоящему времени ни один из этих препаратов не вышел на рынки для парентерального применения у человека. Когда это произойдет, их преимущества и надежность могут оказаться вполне такими же. Следует отметить, что в отличие от катетерных методик введение местных анестетиков в виде депо-препаратов невозможно «выключить»; если пациент (или врач) более не хочет иметь блокаду, придется выжидать — возможно, несколько дней. Кроме того, если препарат окажет токсическое действие, например аллергическое, возможности удалить его быстро не будет.
Б. Коммерчески доступны депо-препараты в виде наклеек или кремов с местным анестетиком, предназначенные для анестезии кожи перед дерматологическими процедурами или для лечения кожной боли (например, «ссадины»). Они довольно эффективны, но и они не лишены риска. В нескольких случаях причиной токсичности ЦНС и метгемогло- бинэмии было признано применение местноанестезирующих кремов у детей.
Заключение
Местные анестетики отличаются скоростью развития действия, его длительностью, соотношением сенсорного и моторного блока, метаболизмом и так далее. Собственные свойства местных анестетиков дополняют различные добавки для изменения их клинического профиля, в большей степени отвечающие требованиям конкретных клинических ситуаций. Знание этих фактов позволит клиницистам делать более рациональный выбор местного анестетика/адьювантов для проведения эффективной и безопасной регионарной анестезии.