A. За последние десятилетия быстро появилось и утвердилось представление о том, какую важную роль в выздоровлении пациентов играет адекватная послеоперационная анальгезия.
1. Традиционный метод назначаемой медсестрами внутримышечной (ВМ) опиоидной анальгезии был замещен более современными и надежными комбинациями препаратов и способов их введения. Хотя опиоиды остаются основными анальгетиками, вариабельная их эффективность и побочные действия побудили к разработке альтернативных систем доставки, таких как анальгезия контролируемая пациентом (АКП) и путей введения (эпидуральный, субарахноидальный и периферический). Желание избежать побочных эффектов от опиоидов также привело к расширению применения местных анестетиков и других анальгетиков.
2. Опасности и преимущества различных подходов подробно изучены в сравнительных исследованиях и описаны со всеми деталями в нескольких полномасштабных учебниках.
3. Необходимость оказания сложной и многокомпонентной помощи привело к созданию «служб острой боли», с анестезиологическим персоналом как интегральной частью.
Б. В США важность адекватного лечения боли привлекла внимание на национальном уровне. Объединенная комиссия выработала собственные стандарты, требующие организации адресного контроля над болью и делающие необходимым требование обеспечить пациентам адекватную оценку и лечение боли. В этих стандартах провозглашено, что боль следует рассматривать как «пятый витальный признак», а ее лечение — как «право пациента».
B. Анестезиологи присоединились к дискуссии по этическим и медикоправовым проблемам оценки и лечения боли. Некоторые авторы признают ее «фундаментальным правом человека», а недостаточное лечение боли как «халатность» и «профессиональное преступление». Другие утверждают, что использование только опиоидных анальгетиков для лечения послеоперационной (и хронической) боли подвергает пациентов ненужному риску седации, угнетения дыхания, тошноты и аллергии. Таким образом, заменяющие опиоиды методики, такие как регионарные блокады, — важный фактор лечения острой послеоперационной боли.
Анальгезия, контролируемая пациентом
А. Первым большим достижением в развитии послеоперационной анальгезии стало изобретение более современных систем доставки, а именно внедрение внутривенной анестезии, контролируемой пациентом (АКП).
1. АКП лучше традиционного внутримышечного пути, поскольку эффективные уровни в крови достигаются сразу после введения, с небольшой задержкой. Контроль пациентом по требованию позволяет каждому пациенту титровать точный уровень, необходимый именно ему, и подстраивать дозы под меняющиеся уровни активности.
2. На рынке есть множество дозаторов, позволяющих пациенту вводить небольшие дозы опиоидов внутривенно тогда, когда он ощущает боль и поддерживать анальгетический уровень в крови. Каждое устройство имеет систему «запора», обеспечивающего адекватную задержку времени, чтобы пациент получал анальгезию от каждой введенной дозы. Избыточное дозирование исключается собственным титрованием пациента, который при получении избыточной дозы в «запертый» период оказывается в состоянии седации, которая не позволит ему ввести лишнюю дозу препарата, способную вызвать угнетение дыхания. Поскольку система доставки поддерживает только уровень в крови, для первичного создания анальгезии нужна болюсная инъекция опоида, обычно обеспечиваемая нагрузочной дозой, программируемой для каждого пациента.
3. Один из неостатков метода — постоянная необходимость повторных инъекций для поддержания уровня в крови, что чаще всего приводит к перерывам сна. Большинство устройств имеют возможность обеспечить постоянную инфузию, поддерживающую базовый уровень, что может смягчить проблему. Постоянная инфузия не уменьшает общее количество введенного; она повышает риск угнетения дыхания устраняя контроль со стороны пациента. Тем не менее она может быть полезной ночью, особенно в первую ночь после операции.
4. Все стандартные системы АКП должны включать альтернативы, которые позволили бы сестринскому персоналу повысить однократную дозу или уменьшить «запертый» интервал — если это нужно пациенту.
5. С помощью АКП применялись практически все доступные опиоиды.
а. Морфин наиболее дешевый и часто оказывается препаратом выбора. Развитие побочных эффектов (тошнота, сыпь, дисфория) могут вынудить к переходу на другой препарат.
б. Мепередин равно эффективен, но его действие немного короче. Мепередин реже применяется в связи с токсичностью его первичного метаболита, нормепередина, особенно при длительном применении и большихдозах.
в. Гидроморфон — мощный анальгетик, и его можно рассматривать как приемлемую альтернативу другим опиоидам.
г. Фентанил дороже, но его применяли пациентам с чувствительностью к другим опиоидам. АКП компенсирует обычный недостаток короткого действия препарата, но пациенту приходится запрашивать дозу чаще.
6. Как уже упоминалось, системы подачи представляются безопасными. Механические проблемы случаются редко. Центральные депрессии случаются, но не чаще, чем при любых других способах введения. Использование постоянной инфузии или преклонный возраст повышают риск угнетения дыхания. Большой проблемой было то, что настройки прибора меняли члены семьи, а не сам пациент, что чревато непреднамеренной передозировкой и угнетением дыхания.
7. В целом, эта система подачи была высокоэффективна в обеспечении хорошей анальгезии у оперированных пациентов.
а. АКП, при сравнении с введением опиоидов медсестрой, неважно — внутривенно или внутримышечно, лучше обеспечивает анальгезию и удовлетворенность пациента.
б. АКП очень эффективна при операциях периферических и на нижних отделах живота, но опиоиды, вводимые нейроаксиально, лучше применять при операциях на верхних отделах живота и грудной клетке.
Б. АКП была адаптирована для подкожного, периневрального и эпидурального катетеров и оказалась высокоэффективной с целевыми системами подачи, обсуждаемыми ниже.
Методики анальгезии локальных и периферических нервов
Несколько локальных и периферических регионарных методик используют для обеспечения анальгезии. Преимущества специфичных целевых анальгетических методик одной зоны включают минимальные ограничения подвижности и снижение системных побочных эффектов, таких как седация и тошнота. При периферических инфузиях обычно используют низкие концентрации местного анестетика, но в некоторых ситуациях применяют также опиоиды и а2-агонисты. Эффективность и популярность постоянных периферических методик усилились после внедрения новых систем доставки для постоянных катетеров и портативных дозаторов небольших размеров.
А. Инфильтрация хирургической раны
1. Простая инфильтрация раны разведенным раствором местного анестетика может обеспечить 4—8 ч анальгезии, в зависимости от локализации, а. Эта методика, в частности, полезна у детей, особенно с блокадами полового члена и в паху.
б. Локальная инфильтрация также эффективна у взрослых амбулаторных пациентов, позволяя выписывать их без побочных эффектов системных опиоидов.
2. У амбулаторных пациентов анальгезию небольших ран можно расширить при помощи катетеров с несколькими отверстиями и постоянной инфузии в них таких растворов, как бупивакаин 0,1%-й или ропивакин со скоростью 6—12 мл/ч. Хирурги-ортопеды используют эту технологию с одноразовыми дозаторами, что обеспечивает 24 ч анальгезии после операций на плече у амбулаторных пациентов.
3. Другой вариант — инъекция в коленный сустав после артроскопичских операций. Бупивакаин обеспечит несколько часов анальгезии, и есть основания полагать, что дополнение в виде таких опиоидов, как морфин, может существенно продлить анальгезию, хотя это предположение остается предметом дискуссий.
Б. Внутриплевральные катетеры
1. Инъекция местных анестетиков через внутриплевральные катетеры прменяласьдляпослеоперационной анальгезии. Методика описана вгл. 10.
2. Для послеоперационной анальгезии 20 мл 0,5%-го бупивакаина можно вводить каждые 6—12 ч или начать постоянную инфузию. Есть сообщения об удовлетворительных результатах применения у некоторых пациентов с подреберными разрезами при холецистэктомии, а также после торакотомии. Другие авторы нашли анальгезию вариабельной со значительным потенциалом системной токсичности — при необходимых дозах.
3. Эта методика не так эффективна, как опиаты, введенные эпидурально после торакотомий.
В. Повторные подреберные блокады
1. Инъекции к 6-11-му межреберным нервам 3—5 мл 0,25%-го бупивакаина с адреналином 1:200 000 с 12-часовыми интервалами обеспечат прекрасную постоянную анальгезию. Их используют не часто, потому что для повторных инъекций каждые 12 ч нужно много времени и персонала — по сравнению с простой и эффективной эпидуральной инфузией.
2. Введение постоянного катетера смягчит часть технических и трудозатратных проблем. Его использование обычно ограничено случаями хрупких пациентов, требующих повышенного внимания, или пациентов с травмой, страдающих от множественных переломов ребер, у которых угнетение дыхания в результате применения опиоидов системно нежелательно, а эпидуральная анальгезия противопоказана.
Е. Катетеры к периферическим нервам. Блокады периферических нервов обеспечивают прекрасную послеоперационную анальгезию как у госпитализированных, так и у амбулаторных пациентов, которую можно продлить при помощи постоянных катетеров. Интерес к этой методике быстро вырос за последнее десятилетие благодаря появлению новых технологий, способствующих выполнению (стимулирующие катетеры, ультразвуковое наведение) и поддержанию (надежные, портативные и одноразовые дозаторы) таких блокад.
1. Углубленное описание установки катетеров к периферическим нервам приведено в предшествующих главах (гл. 15 и 16 для нижних конечностей игл. 12 для верхней).
2. Системы доставки
а. Дозаторы, предназначенные для АКП, такой как эпидуральная анальгезия у госпитализированных пациентов, можно использовать для подачи местного анестетика (с добавками или без) через катетеры к периферическим нервам.
б. Портативные дозаторы доступны и позволяют выписать пациента домой с оставленным катетером.
(1) Первые поколения портативных дозаторов представляли собой эластичные сферы, подававшие растворы со специфической постоянной скоростью, без возможности ввести болюс, до опустошения или отсоединения.
(2) Современные модели представляют собой работающие от батареек одноразовые дозаторы со светящимся диодным (LED) дисплеем/установками, позволяющими настроить постоянную скорость с промежутками для контролируемых пациентом болюсов. Эти дозаторы заполняют раствором местного анестетика на 2—3 дня и после опустошения утилизируют. Пациенты могут удалить свои катетеры дома, по указанию лица, контролирующего их анестезию.
3. Препараты
а. Чаще всего используют разведенные растворы местных анестетиков, особенно длительно действующих амидов. Ропивакаин 0,2%-й обладает таким же анальгетическим профилем, что и бупивакин 0,15% с потенциально менее выраженной моторной блокадой и меньшим риском кардиотоксичности.
б. Некоторые авторы выступают в пользу таких добавок, как клондин и опиоиды, в то время как другие не нашли клинически значимых преимуществ.
4. Результаты
а. Межлестничные катетеры, используемые в течение 2 дней после операции, могут уменьшить боль и потребление опиоидов (наряду с такими побочными эффектами, как тошнота и нарушения сна) у пациентов, перенесших умеренно болезненные амбулаторные операции на плече.
б. Катетеры к бедренному нерву обеспечивают лучшее обезболивание, улучшают восстановление и укорачивают период реабилитации после тотального протезирования коленного сустава выполненного в госпитале — по сравнению с традиционными опиоидами или эпидуральной инфузией. Однако при сравнении отдаленных функциональных результатов, таких как подвижность, различий между постоянной инфузией и блокадой одной инъекцией бедренного нерва, по-видимому, нет.
в. Исследования продемонстрировали, что при использовании портативных систем дозирования тотальные протезирования суставов (включая коленные, тазобедренные и плечевые) можно выполнять в подгруппе пациентов как амбулаторно, так и с госпитализацией наоднуночь.
5. Осложнения и неблагоприятные эффекты случаются редко. Частота
местного воспаления и инфекции составляют менее 1%, даже если
катетер остается на месте в течение 4—7 дней.Даже амбулаторное использование постоянных методик сопровождалось очень небольшим количеством осложнений. Есть сообщения об узлообразовании катетеров вокруг анатомических структур, включая нервы.
Нейроаксиальная анальгезия опиоидами
А. Использование нейроаксиального введения опиоидов было одним из основных открытий в лечении острой боли.
1. Опиоиды, введенные к спинному мозгу, эффективно блокируют передачу боли в дорсальном корешке входной зоны в дозах, значительно меньше тех, что нужны для получения системной анальгезии.
2. Прямое нанесение опиоидов на специфические рецепторные зоны уменьшает системные побочные эффекты угнетения дыхания и седации, обычно сопровождающие внутривенное и внутримышечное введение.
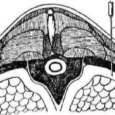
3. Этот эффект наблюдается как при субарахноидальном, так и при эпидуральном введении, хотя эпидуральное применение требует более высоких доз (до 10 крат) для обеспечения проникновения через оболочки.
4. Этот путь введения демонстрирует отличную анальгезию для торакальных и абдоминальных операций (12, 24—26).
Б. Выбор опиоида. Практически все опиоиды применялись для введения
как субарахноидально, так и эпидурально.
1. Эпидуральноевведение
а. Морфин. В связи со своей низкой жирорастворимостью, морфин относительно медленно проникает в липидные слои спинного мозга. Хотя первые исследователи нашли, что они могут преодолеть это за счет более высоких доз, быстро выяснилось, что эти дозы также ассоциируются с повышением частоты побочных эффектов, специфично вызывая центральную седацию и угнетение дыхания, так как водорастворимый морфин в спинномозговой жидкости распространяется краниально.
(1) Приемлемо низкие болюсные дозы обеспечат адекватное обезболивание с минимумом побочных эффектов, если однократная доза введена достаточно рано чтобы дать 60 мин на развитие действия.
(2) Использование постоянной инфузии морфина позволяет избежать феномена пиков и провалов при периодическом введении, а также, по-видимому, ассоциируется с меньшей частотой побочныхэффектов.
б. Фентанил. Поскольку этот препарат в жирах растворяется лучше, он распространяется в СМЖ не так быстро. Исторически считалось, что фентанил (как опиоид с высокой жирорастворимостью) будет вызывать более локальную сегментарную анальгезию с меньшей вероятностью возникновения центрального угнетения дыхания и других побочных эффектов. В настоящее время многие не согласны с тем, что эпидурально введенный фентанил оказывает существенное влияние на спинной мозг и предполагают, что его эффект в основном связан с системной абсорбцией из плазмы.
(1) Было показано, что эпидурально введенный фентанил вызывает локализованную сегментарную анестезию, требуемую при постторакотомной боли, с предположительно более низким профилем побочных эффектов.
(2) Попадание в кровоток значительно, и в нескольких исследованиях было показано, что уровни в крови, полученные в результате эпидуральной инфузии, были равны таковым при внутривенном введении. Некоторые задаются вопросом, есть ли прямое действие на спинной мозг вообще и имеют ли эти препараты какое-либо применение в нейроаксиальной анальгезии.
(3) Другие данные свидетельствуют о том, что при болюсном введении — не инфузии — есть локальное действие на спинной мозг, но только в зоне, непосредственно прилежащей к месту введения.
(4) Несмотря на лабораторные данные, свидетельствующие только о системных эффектах, есть большое клиническое исследование, демонстрирующее высокую степень эффективности эпидуральной инфузии фентанила. Эти исследования показали, что очень важно расположение кончика катетера; он должен быть рядом с дерматомом источника боли. Продемонстрировано, что сочетание с местным анестетиком важно для адекватной анальгезии этим опиоидом. Если нужна анальгезия большого числа спинномозговых сегментов, могут потребоваться более высокие дозы (с усилением системных эффектов) и более востребованными могут оказаться другие опиоиды, с более широким распространением.
а. Суфентанил. В связи с его более высокой жирорастворимостью, требуются еще более высокие дозы. Для эффективной анальгезии дозы суфентанила должны быть равны дозам фентанила, хотя суфентанил может быть эффективным анальгетиком, тем не менее есть опасение, что его эффекты есть простой результат повышения содержания в крови. Как и у фентанила, это было подтверждено при использовании высоких доз. Использование больших объемов более разведенного раствора при инфузии суфентанила улучшает его анальгетический эффект, но преимущества этого препарата перед фентанилом не ясны.
б. Мепередин, гидроморфон. Использование средне-растворимых опоидов, таких как мепередин или гидроморфон, оказывает действие на спинной мозг с более широким распространением и длительностью, чем у фентанила, и, по-видимому, с меньшей выраженностью побочных эффектов. Этот класс может представлять собой идеальный баланс хорошего распространения и меньшей выраженности побочных эффектов.
в. Оптимизация эпидурального введения опиоидов. В целом создается впечатление, что препараты, продуцирующие достаточное распространение, обеспечивают прекрасную анальгезию (морфин), делая это ценой побочных эффектов. Более низкая частота побочных эффектов жирорастворимых препаратов ассоциируется с меньшей эффективностью — если не использовать такой темп инфузии, при котором появляются уровни препарата в системном кровотоке. Это привело многих к мнению, что использование жирорастворимых препаратов следует ограничить случаями, в которых катетер находится в «эпицентре» (или совсем рядом) узкого пояса болезненных дематомов, как при торакотомных разрезах (и, таким образом, боль можно устранить малыми дозами). Более водорастворимые опиоиды выглядят более подходящими для дистальных катетеров (поясничная установка при торакотомной боли) или обширных разрезов (абдоминальная хирургия). К сожалению, пока недостаточно исследований, в которых сравнивали бы различные опиоиды, чтобы на их основании совершать выбор препарата.
2. Интратекальное введение
а. Все опиоиды опробованы и для субарахноидального введения. Требуемые дозы существенно ниже таковых для эпидурального введения, но эффективность этого пути ограничена (обычно) одной инъекцией.
б. После введения, в субарахноидальном пространстве опиоиды не только связываются с рецепторами в дорсальных рогах спинного мозга, но также проходят сквозь твердую мозговую оболочку в эпидуральное пространство, попадают в СМЖ к более краниальным зонам связывания и проникают в плазму. Как и с эпидуральными опиоидами, степень связывания зависит от липофильности препарата.
(1) Липофильные опиоиды, такие как фентанил и суфентанил, быстро проходят через твердую мозговую оболочку в эпидуральное пространство и связываются с рецепторами спинного мозга, а затем «вымываются» в плазму. Такая фармакодинамика ограничивает анальгетическую длительность, но смягчает побочные эффекты, включая угнетениедыхания.
(2) Морфин как гидрофильное соединение остается в СМЖ длительнее. Это пролонгирует анальгезию (на 24 ч или более), но существенно повышает риск краниального распространения препарата, что может привести к угнетению дыхания. Дозо-зависимые взаимоотношения характерны лишь для узкого диапазона доз, и относительно высока частота побочных эффектов. Хотя угнетение дыхания вызывает наибольшее беспокойство, к счастью оно случается редко (менее 0,5% случаев). Снижение уровня сознания является более надежным индикатором угнетения дыхания, чем пульсоксиметрия или частота дыхания. Тошнота и задержка мочи также возможны, каждое осложнение возникает с частотой приблизительно 30%. Наиболее типичен зуд, беспокоящий более половины пациентов.
В. Добавление местных анестетиков
1. Эффективность эпидуральных опиоидов повышается при добавлении разведенных концентраций местных анестетиков, таких как бупивкаин 0,05%-й.
2. Хотя иногда требуются более высокие концентрации бупивакаина (0,1%), максимальная потенциация наблюдается в диапазоне 0,05%. Более высокие концентрации могут улучшить анальгезию усилив сенсорный ее компонент, но они повышают риск моторной блокады и гипотензии вследствие симпатической блокады.
3. Преимущества добавления местных анестетиков к эпидуральной инфузии
а. Мощность эпидуральных опиоидов значительно возрастает.
(1) Добавления местных анестетиков улучшает действие как жирорастворимых, так и водорастворимых (29, 34, 40) опиоидов.
(2) Обеспечивает значительное синергичное улучшение анальгезии, особенно при движении или кашле, которое особенно заметно при использованиижирорастворимых опиоидов.
б. Местные анестетики способствуют восстановлению функции кишечника после абдоминальных операций.
в. Другие меры, основанные на исходах лечения, представлены в разделе IV.
4. Недостатки включают возможность ортостатической гипотензии и сенсорной или моторной слабости, мешающей ходить.
5. Выбор местного анестетика
а. Длительно действующие аминоамиды одинаково эффективны, поскольку все обладают хорошей сенсорно-моторной диссоциацией, а равно и способностью потенцировать опиоиды.
(1) Бупивакаин выбирают чаще других, потому что он эффективен и недорог.
(2) Действие левобупивакаина идентично действию рацемической смеси. Хотя у него может быть ниже потенциал кардиотоксичности, чем у рацемического бупивакаина, в низких концентрациях и при скоростях инфузии, используемых для послеоперационной анальгезии, это преимущество может не оправдать дополнительных расходов.
(3) Ропивакаин изучали как потенциальный анальгетик для инфузии без добавления опиоидов. Он вызывает моторную блокаду в меньшей степени, чем бупивакаин в той же концентрации, но все еще обладает значительным потенциалом моторной блокады в концентрациях, нужных, чтобы вызвать анальгезию без опиоидов. В комбинации с фентанилом в низкой концентрации нет доказательств значительного различия при сравнении с эквипотенциальными смесями с бупивакаином (23, 44, 45). И здесь потенциал кардиотоксичности меньше, хотя при таких низких дозах препарата этот риск не так значителен.
б. Несмотря на массу опубликованных исследований почти всех возможных комбинаций опиоидов с местными анальгетиками, использованных почти при всех типах операций, нет ясных рекомендаций по идеальному соотношению для сочетанной терапии.
(1) В связи с синергизмом, любое уменьшение одного компонента требует увеличения другого. Используя комплексный метод «прямого поиска», Куратоло продемонстрировал эту взаимозависимость между дозами бупивакаина, фентанила и клонидина.
(2) Полезный подход — выбрать опиоид и начать в комбинации с 0,05%-м бупивакаином. Если анальгезия не адекватна с контролируемой пациентом эпидуральной анестезией (КПЭА), базовую скорость инфузии можно увеличить несколько раз в качестве первого шага, а затем повысить концентрацию до 0,1%. Если первым выбором был жирорастворимый опиоид, переход на более водорастворимый (большее распространение) будет следующим шагом.
Е. Другие добавки
1. Несколько других добавок показались обещающими в усилении действия эпидуральных опиоидов или по собственным анальгетическим свойствам.
а. а2-Агонисты (клонидин, дексмедетомидин). Клонидин выглядит наиболее эффективным, но ценой повышения частоты гипотензии и седации, что может ограничивать использование этого препарата при инфузии к периферическим нервам. В настоящее время дексмедетомидин не разрешен для эпидуральной инфузии людям в США.
б. Антагонисты Х-метил-Б-аспарата (NMDA) (кетамин). Была показана эффективность кетамина, но безопасность его пребывания в эпидуральном пространстве не подтверждена.
в. Было показано, что адреналин интенсифицирует анальгезию смесями бупивакаина с фентанилом.
2. В настоящее время большинство служб послеоперационной анальгезии заинтересованы в применении простейших сочетаний ингредиентов — до тех пор, пока не будут получены более надежные доказательства улучшения анальгезии или уменьшения побочных эффектов при помощи добавок.
Д. Системы введения. Как и с комбинациями препаратов, есть немало сообщений, но не хватает хороших сравнений. Однако сделаны достаточно доказательные заключения:
1. Применение торакального эпидурального катетера после торакальных и верхних абдоминальных операций обеспечивает идеальную анальгезию с наименьшими дозами и наименьшей частотой моторной блокады, особенно при использовании более жирорастворимых опиоидов.
2. Хотя создается впечатление, что постоянные инфузии вытеснили методику болюсных инъекций, добавление АКП компонента также улучшает анальгезию и позволяет лучше титровать изменяющиеся нужды пациента. КПЭА не выглядит эффективной без базовой инфузии, но их сочетание обеспечивает, по-видимому, лучшую анальгезию с низким профилем побочных эффектов.
Е. Мультимодальная анальгезия
1. Не существует какого-либо одного идеального препарата, инфузия которого обеспечила бы тотальную анальгезию без побочных эффектов или помех подвижности или восстановлению функции кишечника.
2. Сочетание нескольких модальностей более эффективно, чем режим с одним анальгетиком.
а. Синергизм местных анестетиков плюс опиоиды в эпидуральное пространство обеспечивают анальгезию лучше, чем каждый из них по отдельности, а также более эффективны для ускорения восстановления функции кишечника, чем только опиоиды (как в АКП, так и эпидурально).
б. Применение дополнительно анальгетиков системно, действующих отдельно, обеспечиваетдополнительный синергизм.
(1) Было показано, что назначение нестероидных противовоспалительных препаратов (НПВП) на регулярной основе специфично улучшает анальгезию и уменьшает потребление опиоидов после многих операций, и, таким образом, снижает вероятность таких побочных эффектов, как угнетение дыхания и парез кишечника. В настоящее время большинство служб боли включают НПВП почти во все режимы.
(2) Применение на регулярной основе ацетаминофена обладает похожими достоинствами и также входит в базовые режимы многих служб боли.
(3) Недавно было показано, что антидепрессанты и антиконвульсанты центрального действия, такие как габапентин и прегаблин, усиливают анальгезию, и их назначение перед операцией может быть полезным.
3. Существуют и другие факторы, определяющие окончательное восстановление в дополнение к адекватной анальгезии. Восстановление функции кишечника особенно важно, и ускорение этого процесса было отмечено у пациентов, леченных анальгетическими режимами, уменьшающими парез в сочетании с ранним кормлением по диетам с низким содержанием жиров. Нефармакологическое лечение, включающее раннее возобновление кормления и агрессивную активизацию, может быть полезным, и очевидно, является полем для дальнейших исследований.
Ж. Упреждающее применение
1. Данные исследований на животных дают основания полагать, что предоперационное применение опиоидов нейроаксиально будет значительно притуплять феномен возбуждения спинного мозга, обычно ассоциирующийся с болевой стимуляцией, и будет снижать потребность в анальгетиках в послеоперационном периоде. Данные о людях по этому поводу пока неясны.
2. Хотя вводимые эпидурально опиоиды не обеспечивают адекватной анальгезии при операции как таковой, они могут снижать потребность в анестетиках на 30—40%.
3. Окончательно документировать упреждающий эффект в настоящее время невозможно. В недавно выполненном мета-анализе было продемонстрировано, что упреждающая эпидуральная анальгезия приводила к снижению баллов боли в послеоперационном периоде, уменьшала потребление обезболивающих препаратов в целом и удлиняла время до первой необходимости в анальгетике. Представляется целесообразным начинать эпидуральную анестезию в процессе операции как можно раньше, возможно, устанавливая эпидуральный катетер до операции и введения анестетиков и начиная с комбинированной методики, включающей местный анестетик и опиоид во время операции. Это позволит гладко перейти к эпидуральной инфузии и послеоперационной анальгезии.
3. Лечение побочных эффектов
1. Угнетение дыхания вызывает наибольшее беспокойство.
а. Риск не выше, чем с опиоидами внутримышечно или внутривенно врамкахАКП, при использовании адекватныхдоз.
б. Всех пациентов, получающих опиоиды нейроаксиально, необходимо мониторировать на признаки угнетения дыхания.
(1) Угнетение дыхания возможно в течение 6—18 ч после первой инъекции или начала инфузии.
(2) Большинство авторов согласны, что при интратекальном введении морфина такой мониторинг необходимо продолжать не менее 24 ч после инъекции.
(3) Нет сообщений о случаях угнетения дыхания через 2 ч после итратекального введения фентанила, в связи с чем он рассматривается как достаточно безопасный для амбулаторных условий.
в. К пациентам самого высокого риска относятся пожилые, особенно получающие другие опиоиды и седативы системно. Также повышают риск верхние абдоминальные и торакальные операции. Пациенты, получающие опиоиды хронически, более резистентны.
г. Необходимость применения механических мониторирующих устройств доказать не удалось. При соответствующем обучении сестринского персонала и мониторинге пациентов опиоиды нейроаксиально успешно применяли в общих госпитальных отделениях, и нет необходимости ограничивать их применение в отделениях интенсивной терапии.
(1) Снижение уровня сознания остается лучшим индикатором надвигающейся дыхательной недостаточности, особенно в сочетании со снижением частоты дыхания (менее 10/мин); при этих признаках необходимо начинать лечение антагонистами опоидов.
(2) Однократной внутривенной дозы налоксона недостаточно; угнетение вернется снова через 20 мин, когда закончится действие налоксона. Постоянная инфузия налоксона (5 мкг/кг/ч) устранит угнетение дыхания без противодействия анальгезии и может быть даже рекомендована как профилактическая мера у пациентов высокого риска.
2. Зуд — наиболее типичная жалоба при введении нейроаксиальных опиоидов.
а. Антигистаминные препараты эффективны, но выброс гистамина не является механизмом симптома. Это лечение часто вызывает сдацию и сонливость.
б. Более эффективны антагонисты опиоидов. Небольшие дозы антагониста устранят побочный эффект без реверсии анальгезии. Это характерно для чистых антагонистов, таких как налоксон, или агонистов-антагонистов, таких как налбуфин, который применяли в дозах 1—Змг внутривенно или 10 мг подкожно для устранения этих симптомов.
3. Тошнота менее типична, но также беспокоит пациентов.
а. Симптоматическое лечение любым типичным антиэметиком может быть полезным.
б. Эффективны малые дозы антагонистов или агонистов-антагонистов.
4. Задержка мочи — еще один неприятный побочный эффект, который, к сожалению, не так легко поддается лечению антагонистами. Многим оперированным пациентам, получающим опиоиды эпидурально, одновременно устанавливают мочевой катетер до прекращения инфузии опиоидов.
5. Инфицирование зоны стояния катетера к типичным проблемам не относится. Эпидуральную анальгезию можно продолжать в течение нескольких дней или недель, до тех пор пока изначальная прозрачная повязка, наложенная в асептических условиях, остается на месте и ежедневно мониторируется.
6. Эпидуральная гематома случается редко, но относится к серьезным осложнениям. Выполнение эпидуральной инъекции (или удаление катетера) при наличии нарушений свертывания должны быть тщательно взвешены. При каких-либо сомнениях в возможности формирования гематомы лучше всего из инфузии исключить любые местные анестетики (удалить любые неясности относительно моторной слабости) и начать оценку моторной функции каждые 2 ч.
7. Неадекватная анальгезия встречается, особенно при использовании малых доз у пожилых или «стандартных» доз у молодых, крепких пациентов. При использовании эпидуральной инфузии анальгетиков:
а. Болюсная инъекция фентанила (50—100 мкг) или самого инфузионного раствора обычно улучшат анальгезию на несколько часов, но скорость базовой инфузии необходимо увеличить, если нужно длительное улучшение анальгезии.
б. Если повторные болюсы и увеличение скорости не улучшили анальгезию, эффективность эпидурального катетера необходимо проверить инъекцией 5—10 мл 1,5%-го лидокаина или 2%-го хлоропрокаина. Обычно это вызывает анальгезию на 2 ч и подтверждает правильное положение катетера.
в. Наиболее трудно в этом отношении лечить тех, кто привык к опоидам до операции и, таким образом, обладает повышенной толерантностью или даже зависимостью. В этой ситуации поможет повышение дозы опиоида или введение в эпидуральное пространство более мощного опиоида. Другая альтернатива — эпидуральная инфузия только местного анестетика с предоставлением пациенту внутривенной АКП с опиоидом для того, чтобы «перестраховать» признаки системных эффектов, в то же время позволить ему титровать уровень, отвечающий его потребностям.
Результаты
Все описанные методики, особенно эпидуральная инфузия опиоидов, требуют повышенного внимания и понимания дополнительных опасностей. Важно выстроить использование регионарных методик для послеоперационной анальгезии в правильной риск-польза перспективе.
А. Было показано, что, несмотря на риски побочных эффектов и необходимые усилия, использование эпидуральной инфузии местных анестетиков и опиоидов для послеоперационной анальгезии улучшают исходы лечения пациентов по нескольким существенным направлениям.
1. Качественное обезболивание, особенно динамической боли после торакотомии или верхних абдоминальных операциях (12, 24—26).
2. Послеоперационные респираторные осложнения встречаются реже.
3. Функция кишечника восстанавливается быстрее.
4. Обычное состояние повышенной свертываемости послеоперационного периода смягчается, что уменьшает риск осложнений для сосудистых протезов и снижаетчастоту тромбоэмболическихосложнений.
5. Есть тенденция к снижению гормонального стресса в ответ на операцию, включая снижение выброса катехоламинов, что может быть связано с тенденцией к снижению кардиальных осложнений.
6. В группах повышенного риска со склонностью к кардиальной ишемии, данные также подтверждают, что оптимальное обезболивание, обеспечиваемое эпидуральной анальгезией, ведет к снижению кардиальной летальности.
7. Есть некоторые данные в пользу того, что оптимальное обезболивание, обеспечиваемое эпидуральной анальгезией, может снизить потенциал для развития послеоперационных хронических болевых синдромов.
Б. Блокада периферического нерва также обладает позитивным действием на качество обезболивания при реабилитации. С накоплением таких данных становится более очевидным, что преимущества анальгетических режимов, изложенных выше, значительны, и их применение оправдано.
Служба острой боли
А. Использование такого количества методик, очевидно, сложно и обычно требует создания специальной анестезиологической службы боли. В целом, учреждения, которые организовали службы боли, пришли к выводу, что они представляют собой существенное благо для пациентов в послеоперационном периоде.
Б. Основные проблемы службы острой боли включают следующие.
1. Обучение сестринского персонала и хирургов тому, что описанные ограничения и осложнения этих методов жизненно важны.
2. Экспертное обеспечение также требуется для контроля за дозированием при использовании этих методик, ведение необычных осложнений и особенно технических проблем с катетерами эпидуральными и к периферическим нервам. Эти проблемы требуют круглосуточной доступности бригады опытных анестезиологов. Такая служба требует ответственного отношения анестезиологического персонала, и, в более крупных госпиталях, часто требует круглосуточного дежурства в самом госпитале. В небольших районных госпиталях было возможно обеспечивать службы боли по принципу дежурства на дому, но это требует интенсивного обучения всего сестринского персонала и полного набора постоянно действующих указаний для покрытия внезапных событий. Идеально, если такая бригада не реже двух раз в день делает обход пациентов с болями и постоянно доступна для консультаций.
3. Принципиально важным компонентом этой службы является разработка постоянно действующих методичек, обеспечивающих четкое руководство для персонала отделений по распознаванию и первичному лечению осложнений и побочных эффектов, описанных выше. Полезно использование стандартных протоколов назначения анальгетиков, равно как и набора постоянно действующих приказов по ведению осложнений. В постоянно действующие приказы должны входить конкретные действия по адекватному респираторному мониторингу и распределение действий сестринского персонала отделения по первичному лечению (обычно с налоксона) до прибытия сотрудников службы боли.
В. Работа службы боли значительно улучшается, если в нее входят специально обученные медсестры. Они помогают в обучении и поддержке медсестер отделений, а также обеспечивают постоянный и последовательный уровень ухода за пациентом.