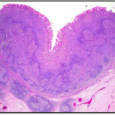
Неясно, по каким механизмам инфекция H. pylori приводит к генетическим изменениям, которые в конечном итоге заменяют нормальный желудочный эпителий неопластическим.
Широкие доказательства подтверждают, что окислительный стресс вызывает клеточные изменения, которые могут начаться и поддерживать процесс канцерогенеза. Подстрекательские клетки, притягиваемые к слизистой оболочке желудка с помощью инфекции, приводят к экспрессии индуцируемой синтазы оксида азота (iNOS) (Mannick et al., 1996), что может привести к высоким концентрациям оксидов азота, особенно в липидсодержащих клеточных мембранах ( Liu et al., 1998). INOS также присутствует в цитоплазме метапластических, диспластических и эпителиальных раковых клеток (Piazuelo et al., 2004; Pignatelli et al., 2001). Накопление реакционноспособных видов кислорода и азота может привести к окислению, нитрованию и нитрозированию молекул, приводящих к изменениям ДНК и белка. Мутагенные эффекты оксидов азота, по-видимому, противодействуют ДНК-защищающим ферментам, также обнаруженным в воспалительном инфильтрате, таком как супероксиддисмутаза и каталаза (Pignatelli et al., 1998). Субъекты, инфицированные генотипом cagA-положительным, vacAs1m1 и iceA1 H. pylori, показали более высокие уровни повреждения окислительной ДНК, чем неинфицированные пациенты или пациенты, инфицированные генотипом cagAnegative, vacAs2 m2 и iceA2 H. pylori (Ladeira et al., 2007).
Были разработаны несколько моделей канцерогенеза. Одна из них предлагает, чтобы желудочный предраковый каскад представлял собой последовательное накопление устойчивых мутаций и других молекулярных аномалий, подобных модели Фогельштейна канцерогенеза толстой кишки (Fearon and Vogelstein 1990, Smith et al., 2006; Yasui et al., 2006). В поддержку этой модели несколько отчетов описали изменения в протоонкогенах, генах супрессоров опухолей, регуляторах клеточного цикла и факторах роста. Множество сообщений об аномалиях и отсутствие убедительных доказательств их последовательного накопления вызывали некоторые сомнения относительно актуальности такой модели канцерогенеза желудка. Еще одна слабость этой модели заключается в том, что описанные аномалии не учитывают инвазивную способность пораженных эпителиальных клеток.
Вторая предложенная модель, называемая моделью дедифференциации / повторной дифференциации, учитывает инвазивную способность раковых клеток. Эта активность связана с способностью некоторых агентов трансформировать эпителиальные клетки в мезенхимальные клетки. Эпителиально-мезенхимный переход (ЕМТ), нормальный процесс эмбриогенеза, хорошо изучен у морского ежа и при колоректальном раке (Kirchner and Brabletz 2000). Этот процесс управляется сигнальным путем β-catenin / Wnt. В отсутствие передачи сигналов Wnt внутриклеточные уровни β-catenin регулируются мультибелковым комплексом, который способствует его деградации. Напротив, в присутствии лиганда Wnt коактивация рецепторов приводит к ингибированию комплекса деградации и внутриклеточного накопления β-катенина, что приводит к ядерной транслокации. В ядре β-catenin связывается с семейством транскрипционных факторов TCF / LEF, модулируя экспрессию широкого спектра генов-мишеней. В карциномах человека лучшие дифференцированные железы опухоли отображают β-catenin в апикальной цитоплазме и клеточной мембране, что указывает на ее участие в клеточной клеточной адгезии. В инвазивном краю опухолевые клетки теряют свой эпителиальный фенотип и приобретают дедифференцированный, мезенхимоподобный фенотип, с накоплением ядерного β-катенина. Основным следствием ЕМТ является приобретение подвижности и инвазивности. Наблюдение, что метастазы многих карцином повторяет эпителиальную дифференциацию и морфологию первичной опухоли, указывает на повторную дифференцировку на эпителиальный фенотип первичной опухоли (Brabletz et al., 2002; Brabletz et al., 2005). При канцерогенезе желудка онкогенный адаптированный к грызунам 7,13 штамм H.pylori активирует β-catenin в эпителиальных клетках, что зависит от транслокации CagA в эпителиальные клетки хозяина. Ядерный β-катенин увеличивается в желудочном эпителии от песчанок, инфицированных канцерогенным штаммом H.pylori, а также у лиц, несущих отрицательные штаммы cagA-позитивные или cagA-отрицательные или неинфицированные. Эти результаты показывают, что активация β-catenin H. pylori может быть важным ранним событием, которое предшествует злокачественной трансформации (Franco et al., 2005).
Есть новые данные, подтверждающие происхождение неопластических и предэкластических клеток желудка из клеток, полученных из костного мозга (BMDC), на слизистую оболочку желудка в результате инфекции H.pylori (Houghton et al., 2004) , Li et al., 2006). Отличительной чертой BMDC является отсутствие β-catenin в комплексах клеточных соединений и его ядерная локализация. С этой точки зрения, похоже, что модель BMDC и модель дедифференцировки / редифференциации, основанная на Wnt / β-catenin, являются взаимодополняющими.