Кальций и фосфат содержатся в основном в костях, хотя в небольших количествах эти жизненно необходимые компоненты находятся и в крови. Два теста, рассматриваемые в этой главе (определение сывороточной / плазменной концентрации кальция и фосфата), часто выполняются вместе с двумя другими анализами, определением концентрации альбумина и активности щелочной фосфатазы. Эти четыре теста, составляющие вместе так называемый «костный профиль», в первую очередь выполняются при подозрении на метаболические заболевания костей. Причина заболевания костей часто кроется в дисфункции органа, который участвует в регуляции концентрации кальция и фосфата в плазме (например, паращитовидных желез, почек или желудочно-кишечного тракта). Следовательно, определение этих показателей часто требуется пациентам, страдающим заболеваниями этих органов. Существует еще три большие группы пациентов, которым необходимо определение кальция. Это онкологические больные, лица, находящиеся в критическом состоянии, и недоношенные младенцы.
Перечень лабораторных анализов в отделениях интенсивной терапии часто включает измерение плазменной концентрации кальция. Следовательно, средние медицинские работники должны знать, как выполняется это исследование.
Пищевые источники кальция и фосфора
В обычном ежедневном рационе европейца в среднем содержится порядка 1000 мг кальция. Рекомендуемый минимум для взрослых составляет 700 мг кальция в день. Основной источник кальция — молоко и молочные продукты. Кроме того, этот элемент содержится в листовых зеленых овощах, бобах сои и орехах. Кальцием обогащают муку и некоторые сухие завтраки-мюсли. В некоторых районах много кальция содержится в водопроводной воде. Менее половины полученного с пищей кальция всасывается в кишечнике, в основном в двенадцатиперстной кишке. Остальное выводится с калом. В организме уровень кальция находится под гормональным контролем, что обеспечивает баланс между потребностью в этом элементе и его поступлением.
Большинство продуктов питания содержит фосфор, обычно ежедневно с пищей поступает 1000 мг этого элемента. Больше всего фосфора содержится в мясе и молочных продуктах.
Распределение кальция и фосфата в организме
В организме взрослого человека содержится около 1 кг кальция (Са) и 600 г фосфора (Р), последний — в комбинации с кислородом — в виде оксида (РО4). Основное количество кальция (99%) и фосфата (85%) приходится на кости, где они входят в состав кристаллов гидроксиапатита — Са10(РО4)6OН2.
Кристаллы гидроксиапатита вместе с белком коллагеном являются основными структурными компонентами костей и зубов. Кальций и фосфор в совокупности составляют 65% массы костей. Незначительное количество кальция (<1%), находящегося в костях, обменивается с кальцием крови. Это позволяет выводить в кровь излишек кальция, когда его уровень в костях выше необходимого, и обеспечивает обратный транспорт, если в крови содержание элемента понижено.
В крови циркулирует около 350 мг (8,7 ммоль) кальция, концентрация его при этом составляет 2,5 ммоль/л. Половина этого количества связывается с белком альбумином, а остальной кальций находится в ионизированной (Са2+), свободной форме. Именно свободная фракция кальция физиологически активна. Эта очень маленькая, но жизненно важная часть общего пула кальция содержится в каждой клетке организма. Концентрация кальция в клетках измеряется в нмоль/л, что составляет всего 1/1000 от уровня в плазме крови.
Не входящие в состав костной ткани 15% фосфата распределяются между клетками и внеклеточным пространством, включая кровь. В плазме содержится 1% общего пула элемента в организме (концентрация составляет примерно 1 ммоль/л).
Функции кальция и фосфата
И кальций, и фосфат играют важнейшую роль как основные компоненты костей и зубов. Ионизированный кальций, циркулирующий в плазме, — это кофактор, необходимый для работы ферментов, участвующих в процессе свертывания крови. Это также источник кальция, требующегося для осуществления многих других клеточных процессов, например электрического проведения нервного импульса, сокращения скелетной мускулатуры и сердечной мышцы, нервно-мышечной передачи. Регуляция при участии кальция — неотъемлемая часть множества процессов, в которых гормоны действуют на клетки-мишени. Таким образом, функционирование многих гормонов зависит от уровня ионизированного кальция. Фактически немногие физиологические функции могут осуществляться без участия хотя бы минимального количества ионов кальция внутри клетки.
Фосфат входит в состав ключевых биологически активных молекул: нуклеиновые кислоты (ДНК и РНК), фосфолипиды (структурные компоненты всех клеточных мембран) и многие другие интермедиаты, включая аденозинтри- фосфат (АТФ) — основной источник химической энергии в клетке. Неорганический фосфат (тот, который не входит в состав более крупных органических молекул) действует в крови и моче как буфер, участвуя в таком жизненно важном процессе, как поддержание нормального уровня рН крови.
Многие функции кальция и фосфата зависят от поддержания их уровня в плазме в достаточно узких пределах. В следующем разделе описаны механизмы, поддерживающие нормальную концентрацию кальция в плазме. Нарушение одного или нескольких механизмов часто служит причиной патологических изменений содержания кальция и/или фосфата.
Физиологический контроль концентрации кальция в плазме
Концентрация кальция в плазме отражает баланс между его поступлением с пищей с последующим всасыванием в желудочно-кишечном тракте и выведением его из организма с мочой. Кроме того, как уже отмечалось, кальций может циркулировать между плазмой и костями. Эти пути транспорта кальция и, соответственно, его концентрация в крови находятся под контролем двух гормонов — паратгормона (паратиреоидный гормон, ПТГ) и кальцитриола (производное витамина D). Эти же гормоны регулируют и уровень фосфата в плазме.
Источник, секреция и эффекты паратгормона
ПТГ — гормон, регулирующий уровень кальция, продуцируется и секретируется четырьмя крошечными (с рисовое зерно) паращитовидными железами, расположенными близко к поверхности или прямо на щитовидной железе. Клетки паращитовидных желез чувствительны к концентрации ионов кальция в крови, омывающей железу. Уменьшение концентрации приводит к стимуляции желез, продукции и секреции ими ПТГ. ПТГ транспортируется с кровью к двум органам-мишеням — почкам и костям.
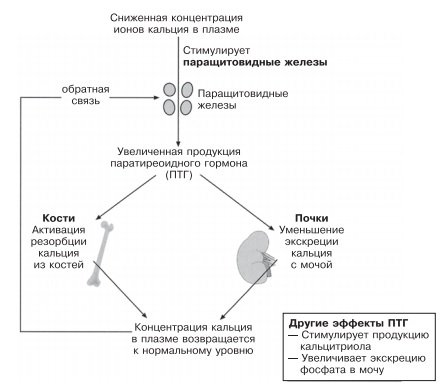
Регуляция концентрации кальция в плазме паратиреоидным гормоном
В результате из костей в кровь высвобождается кальций и уменьшается его почечная экскреция в мочу. В итоге происходит восстановление нормального уровня кальция в плазме. При повышении концентрации кальция в крови секреция ПТГ подавляется. Этот гормон также снижает уровень фосфата посредством действия на почки, усиливая его секрецию в мочу. Конечный результат действия ПТГ — увеличение концентрации кальция и снижение концентрации фосфата в крови.
Источник, секреция и эффекты кальцитриола
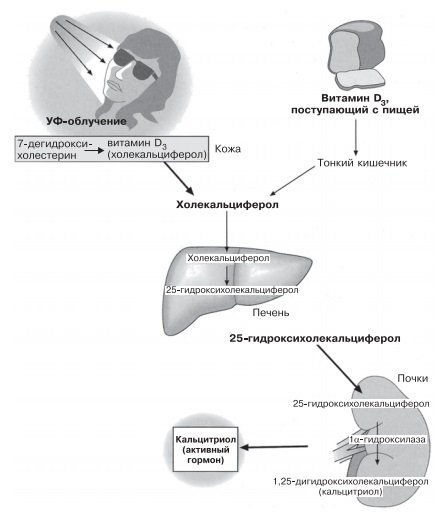
Кальцитриол (1,25-дигидроксихолекальциферол) — второй гормон, регулирующий уровень кальция. Это производное витамина D, высвобождаемое почками. Витамин D не только поступает в организм с пищей, но еще и синтезируется в коже под действием солнечного света из холестериноподобного вещества — 7-дегидроксихолестерина. Независимо от источника поступления в организм витамин D в двухступенчатом процессе превращается в кальцитриол. Первая реакция происходит в печени, вторая — в почках. Вторая реакция, в результате которой кальцитриол поступает из почек в кровь, находится под контролем ПТГ. Когда уровень кальция в плазме снижен и, следовательно, уровень ПТГ повышен, продукция и секреция кальцитриола почками также усиливаются. Этот процесс, как и продукция и секреция ПТГ, запускается в случае снижения содержания ионов кальция в крови, а ингибируется при его повышении или увеличении уровня фосфата.
Кальцитриол действует прежде всего на желудочно-кишечный тракт, где стимулирует всасывание поступающих с пищей кальция и фосфата. Эффект этого гормона заключается в увеличении их содержания в плазме. Вместе с ПТГ кальцитриол поддерживает на физиологическом уровне концентрации кальция и фосфата в крови.
Таким образом, поддержание нормальных уровней кальция и фосфата в плазме зависит от:
- диеты, содержащей необходимые количества кальция, фосфора и витамина D;
- нормального функционирования желудочно-кишечного тракта, обеспечивающего всасывание этих трех нутриентов;
- инсоляции, достаточной для адекватного эндогенного синтеза витамина D;
- функции паращитовидных желез, секретирующих ПТГ;
- нормального функционирования печени и почек, в которых происходит превращение витамина D в кальци- триол;
- нормального функционирования почек, обеспечивающих секрецию кальцитриола и, таким образом, регуляцию экскреции кальция и фосфата с мочой;
- состояния метаболизма костной ткани, обеспечивающего физиологический обмен кальция (и фосфата) между кровью и костями.
Для жизнедеятельности поддержание определенного уровня ионов кальция важнее в плазме, чем в костях, поэтому, если запасы кальция ограничены, организм жертвует минерализацией костей для обеспечения нормальной концентрации Са 2+ в плазме.
Концепция скорректированного, или стандартизированного, общего кальция плазмы
Как уже было сказано, кальций находится в крови в виде двух почти равных фракций: половина его связана с альбумином, половина представлена ионами кальция (Са2+). В идеале нужно было бы определять физиологически активный ионизированный кальций, но по причинам, которые будут описаны ниже, принято определять общий кальций плазмы (т. е. кальций, связанный с альбумином, плюс свободный ионизированный кальций). Правомерность определения общего кальция вместо ионизированного обусловлена тем, что концентрация связанного кальция постоянна, а концентрация свободного кальция может изменяться; таким образом, концентрация общего кальция тоже изменяется.
На практике, если концентрация альбумина в плазме остается постоянной, то и количество кальция, связанного с альбумином, тоже постоянно. В этом случае концентрация общего кальция точно отражает концентрацию ионизированного кальция. Однако если концентрация альбумина в плазме отклоняется от нормы, то концентрация общего кальция тоже становится аномальной, что создает впечатление об отклонении от нормы ионизированного кальция.
Для преодоления этой проблемы важно при интерпретации результатов анализа общего кальция принимать во внимание концентрацию в плазме альбумина. Если альбумина в плазме больше или меньше нормы, необходимо провести коррекцию результатов с помощью следующей наиболее часто используемой формулы.
Если альбумин плазмы больше 45 г/л, то скорректированный общий кальций (ммоль/л) = общий кальций (ммоль/л)
Если альбумин плазмы меньше 40 г/л, то скорректированный общий кальций (ммоль/л) = общий кальций (ммоль/л)
В сущности, концентрация скоректированного общего кальция — это концентрация общего кальция, которая была бы получена при нормальных значениях концентрации альбумина.
В настоящее время в большинстве лабораторий определяют в образцах крови наряду с общим кальцием концентрацию альбумина и автоматически выдают результат, который соответствует концентрации скорректированного общего кальция. Если какая-либо лаборатория придерживается других правил, то врач (при подозрении, что концентрация альбумина может отклоняться от нормы) может попросить сделать анализ альбумина вместе с анализом общего кальция.
Определение ионизированного кальция плазмы
В отделениях интенсивной терапии, имеющих соответствующее оборудование, определяют физиологически активную фракцию — ионизированный кальций. В клинической лаборатории может отсутствовать оборудование для измерения ионизированного кальция, поэтому у врача должны быть очень веские основания для назначения анализа ионизированного кальция вместо общего кальция плазмы.
Подготовка пациента
Никакой особой подготовки пациента к взятию крови не требуется.
Время взятия крови
Взять кровь для определения уровня кальция и фосфата можно в любое время.
Подготовка образца
Определение общего уровня кальция в плазме в условиях диагностической лаборатории
Для выполнения анализа в условиях лаборатории берут около 5 мл венозной крови. Определение можно проводить как в сыворотке, так и в плазме крови. Если в вашей лаборатории используют для определения сыворотку, то кровь собирают в пробирку без антикоагулянта. Если же используют плазму, то нужны пробирки с антикоагулянтом — гепарином лития. Другие антикоагулянты при взятии крови для измерения уровня кальция и фосфата не подходят.
Так как наложение жгута может повлиять на измерение содержания кальция, этим приемом в данном случае не пользуются. При неправильной технике взятия крови могут повреждаться клеточные мембраны, что приводит к гемолизу. Фосфата больше внутри клеток крови, чем в плазме, поэтому повреждение мембран приводит к выходу фосфата в плазму и, следовательно, к завышению результатов. В гемолизированных пробах определять уровень фосфата нельзя.
Если у больного нет результатов свежего анализа альбумина, то следует сделать его параллельно с определением содержания кальция.
Определение уровня ионизированного кальция в отделении интенсивной терапии
В современных газовых анализаторах, используемых в отделениях и палатах интенсивной терапии, часто есть встроенный блок для одновременного определения концентрации кальция с использованием тех же антикоагулянтов для артериальной крови. Это позволяет оценить физиологически активную фракцию общего кальция — ионизированный кальций. В этом случае необходимо соблюдать те же правила сбора проб, что и для анализа газового состава крови, даже если требуется определить только уровень ионов кальция.
Содержание ионизированного кальция можно измерять не только в артериальной, но и в венозной крови, соблюдая требования, предъявляемые к сбору образцов артериальной крови для определения газов. Для интерпретации полученных результатов не нужно иметь результаты оценки концентрации альбумина. Потребность в определении содержания фосфата в условиях блока интенсивной терапии крайне низкая; чаще это исследование проводят, используя технологии стационарных лабораторий.
Интерпретация результатов
Для интерпретации результатов определения уровня кальция необходимо знать концентрацию альбумина в плазме и рН крови.
Влияние рН на уровень кальция
На соотношение ионизированного и неионизированного кальция оказывает влияние рН крови. При высоких значениях рН (алкалоз) меньше кальция находится в ионизированном виде, при низких (ацидоз) — больше. Клиническое значение этого влияния продемонстрировано в истории болезни. Можно сказать, что при нарушении кислотно-основного баланса интерпретация результатов определения уровня кальция в крови несколько затрудняется.
Нормы:
концентрация кальция в сыворотке/плазме (общий Са, с поправкой) — 2,20-2,60 ммоль/л;
концентрация ионов кальция в плазме — 1,15-1,30 ммоль/л;
концентрация фосфата в сыворотке/плазме — 0,80-1,40 ммоль/л.
Критические значения:
концентрация кальция в сыворотке/плазме (общий Са, с поправкой) < 1,50 и > 3,30 ммоль/л;
концентрация ионов кальция в плазме< 0,80 и > 1,60 ммоль/л.
Термины, используемые при интерпретации
Гиперкальциемия — концентрация кальция в сыворотке / плазме (общий Са, с поправкой) > 2,60 ммоль/л или концентрация ионов кальция в плазме > 1,30 ммоль/л.
Гипокальциемия — концентрация кальция в сыворотке / плазме (общий Са, с поправкой) < 2,20 ммоль/л или концентрация ионов кальция в плазме < 1,15 ммоль/л.
Гиперфосфатемия — концентрация фосфата в сыворотке / плазме > 1,40 ммоль/л.
Гипофосфатемия — концентрация фосфата в сыворотке / плазме < 0,80 ммоль/л.
Причины гиперкальциемии
Наиболее частые причины гиперкальциемии — это злокачественные заболевания (рак) и первичный гипрепаратиреоз.
Гиперкальциемия и онкологические заболевания
Считается, что избыточная продукция опухолевыми клетками полипептида, называемого родственным (подобным) паратгормону белком (ПТГсБ), — основная причина гиперкальциемии у онкологических больных. Как следует из названия этого белка, он структурно и функционально подобен продуцируемому паращитовидными железами ПТГ, регулирующему кальциевый обмен. Действие ПТГсБ подобно действию ПТГ: он вызывает высвобождение кальция из костей в кровь и, соответственно, увеличение его уровня в плазме. Но концентрация ПТГ в плазме находится под контролем содержащегося в ней кальция (продукция гормона активируется при снижении уровня кальция и снижается при его увеличении), а синтез ПТГсБ злокачественными клетками — нет. Неизбежное следствие неконтролируемого синтеза ПТГсБ опухолевыми клетками — снижение уровня кальция в костях ниже нормы и значительное увеличение его концентрации в крови.
Гиперкальциемия характерна для всех разновидностей опухолевых поражений. С большей вероятностью она встречается при опухолях легких, молочной железы, гортани, области головы и пищевода, чем у больных с опухолями почек, желудка и кишечника.
Чаще всего гиперкальциемия обнаруживается у больных с множественной миеломой (примерно у половины) и опухолями костного мозга. В этих случаях причина гиперкальциемии не в избыточной продукции ПТГсБ, а в деструкции костной ткани (следовательно, высвобождении кальция) в результате инфильтрации опухолевыми клетками.
В целом гиперкальциемия регистрируется на поздней стадии развития солидного рака кости, когда опухолевый процесс широко распространился из первичного очага, и служит, таким образом, плохим прогностическим признаком. Уровень кальция в крови важно определять еще и потому, что лечение приводит к его нормализации и снятие симптомов гиперкальциемии может улучшить качество жизни онкологических больных.
Первичный гиперпаратиреоз
Постоянно повышенный уровень кальция в крови при отсутствии злокачественных новообразований свидетельствует в пользу первичного гиперпаратиреоза — второй наиболее часто встречающейся причины гиперкальциемии у госпитализированных больных и первой — в общей популяции. Хотя это состояние встречается у людей разного возраста и пола, чаще им страдают женщины в период постменопаузы. Почти во всех случаях первичного гиперпаратиреоза причиной избыточной неконтролируемой секреции ПТГ оказывается доброкачественная опухоль (аденома) одной из четырех паращитовидных желез. Значительно реже это следствие патологического увеличения (гиперплазии) всех паращитовидных желез.
Во многих случаях гиперкальциемия выявляется случайно при биохимическом скрининге, выполняемом для того, чтобы объяснить наблюдаемые у пациента симптомы, не связанные явно между собой. В течение нескольких лет до постановки диагноза больного могут беспокоить неспецифические признаки гиперкальциемии (например, депрессия, запор), а у некоторых пациентов (особенно при умеренной гиперкальциемии — 2,60-2,80 ммоль/л) вообще не наблюдается каких-либо ее симптомов. Без лечения первичный гиперпаратиреоз может вызывать деминерализацию костей (вследствие неконтролируемого воздействия ПТГ на костную ткань), отложение кальция в почках и их заболевание, образование кальциевых камней в мочевых путях и (в редких случаях) очень тяжелую гиперкальциемию с угрозой для жизни. Единственный метод лечения — оперативное удаление аденомы.
Редкие причины
В 80% случаев гиперкальциемию вызывают обсуждаемые выше причины. Такие весьма распространенные заболевания, как хроническая почечная недостаточность и тиреотоксикоз, довольно редко ассоциируются с гиперкальциемией.
Примерно у 10% больных саркоидозом, представляющим собой редкое заболевание, которое поражает преимущественно легкие, наблюдается гиперкальциемия из-за избыточной продукции кальцитриола и соответствующего усиления всасывания пищевого кальция. Этот же механизм лежит в основе развития гиперкальциемии при туберкулезе легких и потреблении витамина D в слишком высоких дозах. Наконец, гиперкальциемию могут вызывать некоторые лекарственные средства, особенно тиазидные диуретики и препараты лития. Иногда причину гиперкалициемии найти так и не удается.
Причины гипокальциемии
Гипокальциемия встречается гораздо реже, чем гиперкальциемия. Так как концентрация кальция в плазме возрастает под действием таких гормонов, как ПТГ и кальцитриол, можно ожидать, что их дефицит или ослабление эффекта может приводить к гипокальциемии.
Гипопаратиреоз: сниженная продукция паратгормона
Гипопаратиреоз относится к редким состояниям. Чаще всего он развивается в результате повреждения паращитовидных желез при хирургических вмешательствах. Анатомическая близость и обильное кровоснабжение щитовидной и паращитовидных желез делает последние особенно уязвимыми при выполнении операций на щитовидной железе. Свою роль играют также маленький размер и вариабельность анатомии паратиреоидных желез. По тому же механизму развивается гипокальциемия после удаления аденомы паращитовидных желез у больных с первичным гиперпаратиреозом.
Приблизительно у 14% пациентов, подвергшихся тотальной тиреоидэктомии, развивается временный гипопаратиреоз. Устойчивый гипопаратиреоз встречается после таких операций значительно реже — примерно у 2% прооперированных больных. Риск развития гипопаратиреоза с последующей гипокальциемией зависит от обширности хирургического вмешательства на щитовидной или паращитовидных железах, но для всех больных после операции должен быть налажен мониторинг уровня кальция в плазме. К более редким причинам развития гипопаратиреоза и связанной с ним гипокальциемии относятся поражение паращитовидных желез в результате аутоиммунного заболевания и их врожденное отсутствие или недостаточное развитие.
Сниженная продукция кальцитриола
Гипокальциемия сопутствует такому заболеванию костей в детском возрасте, как рахит, и его эквиваленту у взрослых — остеомаляции. В обоих случаях она возникает в результате дефицита витамина D — предшественника кальцитриола. Гипокальциемия развивается из-за недостатка кальцитриола, который приводит к ограничению всасывания кальция и фосфата, поступающих с пищей. Способствующий развитию гипокальциемии дефицит витамина D может быть следствием недостаточного поступления с продуктами питания или заболеваний желудочнокишечного тракта (например, колит, болезнь Крона либо поджелудочной железы — хронический панкреатит, ограничивающих всасывание витамина даже при достаточном его поступлении. Причиной авитаминоза может быть также редкое пребывание на солнце, что затрудняет синтез витамина D.
В норме физиологический ответ на уменьшение уровня кальция в плазме независимо от его причины заключается в усилении продукции ПТГ и, значит, высвобождении кальция из костей в кровь. Если дефицит витамина D не корригирует, секреция ПТГ остается повышенной. Вымывание кальция из костей, индуцируемое ПТГ, приводит к их деформации у детей при рахите и деминерализации у взрослых при остеомаляции.
Гипокальциемия часто встречается при хронической почечной недостаточности и несколько реже при хронических болезнях печени и первичном билиарном циррозе. Это отражает ключевую роль, которую играют почки и печень в превращении витамина D в кальцитриол, и важное значение почек в минимизации потерь кальция с мочой. Гипокальциемия при хронических заболеваниях печени усиливается при дефиците витамина D из-за снижения продукции желчи (желчные кислоты необходимы для всасывания этого витамина). Некоторые антиконвульсанты, метаболизирующиеся в печени, ограничивая печеночный метаболизм витамина D, также могут ингибировать синтез кальцитриола. Поэтому больные, длительно использующие эти препараты, имеют в перспективе риск развития гипокальциемии с последующей деминерализацией костей.
Гипокальциемия в критических состояниях
Гипокальциемия часто развивается у больных, находящихся в критическом состоянии (до 85%). В этих условиях определяют только фракцию ионизированного кальция, поскольку поправка к уровню общего кальция на содержание альбумина в крови (см. выше) для таких больных не корректна. В отделениях интенсивной терапии причинами гипокальциемии у больных наиболее часто служат острая почечная недостаточность, алкалоз, сепсис, острый панкреатит, тяжелые ожоги и рабдомиолиз. Вызывать гипокальциемию может и массивная гемотрансфузия.
Неонатальная гипокальциемия
Гипокальциемия нередко наблюдается в первые один-два дня жизни. Для фетального развития костей требуется относительно высокое содержание кальция в плазме in utero. Физиологический процесс перехода плода из внутриматочного существования к неонатальной независимости сопровождается быстрым снижением уровня кальция в плазме в первые 24-48 ч жизни. Предполагается, что преходящая неонатальная гипо- кальциемия развивается вследствие недостаточной зрелости паращитовидных желез (продукция ПТГ в ответ на снижение концентрации кальция ограничена) у новорожденного (временный гипопаратиреоз). Риск развития гипокальциемии по этому механизму особенно высок у недоношенных младенцев и новорожденных с низким весом, а также у детей, родившихся у матерей, страдающих сахарным диабетом.
Считается, что более поздняя неонатальная гипокальциемия, развивающаяся на второй неделе после рождения, отражает неадекватный ответ почек (вследствие их незрелости) на ПТГ. Недостаточность витамина D у младенца в результате его дефицита у матери во время беременности также может приводить к гипокальциемии в раннем детском возрасте.
Причины гиперфосфатемии
Почки, которые регулируют содержание фосфата в организме человека, выводя его излишки с мочой, играют в поддержании нормальной концентрации фосфата в крови центральную роль. Поэтому наиболее частой причиной повышения уровня фосфата в сыворотке/плазме крови оказывается почечная недостаточность (как острая, так и хроническая): из-за потери почками способности выводить излишек фосфата с мочой увеличивается его концентрация в крови.
Избыточное поступление фосфата в организм редко бывает причиной развития гиперфосфатемии. Это может наблюдаться у больных, находящихся на парентеральном питании. Поскольку витамин D усиливает абсорбцию фосфатов из пищи, причиной гиперфосфатемии может быть и передозировка этого витамина.
Значительно более высокое содержание фосфата в клетках/ тканях по сравнению с его уровнем во внеклеточной жидкости (крови) приводит к тому, что при массивной деструкции тканей (например, при рабдомиолизе) существенно возрастает концентрация фосфата в крови за счет выхода из поврежденных клеток. По этому же механизму гиперфосфатемия развивается при любых заболеваниях или лечении (например, при химиотерапии), сопровождающихся усилением катаболических процессов.
Как уже отмечалось, важную роль в регуляции уровня фосфата в крови играет ПТГ, который увеличивает его почечную экскрецию. Это объясняет увеличение концентрации фосфата в плазме при недостаточности ПТГ (гиперпаратиреозе).
Причины гипофосфатемии
Гипофосфатемия развивается по трем основным механизмам: снижение поступление фосфата с пищей, увеличение потерь фосфата (с мочой) и усиление транспорта фосфата из плазмы крови в клетки.
Присутствие фосфатов практически во всех продуктах питания объясняет редкость развития гипофосфатемии по этому механизму, однако это случается при продолжительной алиментарной недостаточности (например, при алкоголизме или таких нарушениях питания, как нервная анорексия). У людей, страдающих хроническими желудочно-кишечными заболеваниями, (например, болезнью Крона или целиакией), гипофосфатемия возникает в результате неадекватного всасывания фосфата из пищи. В данном случае она выступает как компонент общего синдрома мальабсорбции, затрагивающего всасывание многих других нутриентов. Поскольку для синтеза кальцитриола, необходимого для осуществления физиологического всасывания фосфата, необходим витамин D, дефицит последнего также может приводить к развитию гипофосфатемии.
Гипофосфатемия, возникающая в результате усиления транспорта фосфата из крови в клетки, характерна для диабетического кетоацидоза и респираторного алкалоза.
Последствия патологических изменений уровня кальция и фосфата в сыворотке крови
Основные клинические последствия изменения нормального уровня кальция в крови объясняются его центральной ролью в передаче сигналов между нейронами (нейротрансмиссия) и в нервно-мышечных соединениях (нейромышечная трансмиссия). Поскольку функционирование нервной системы, скелетных мышц, сердца и желудочно-кишечного тракта во многом зависит от этих опосредованных ионами кальция сигналов, все они — вместе или по отдельности — могут страдать, если содержание кальция в плазме выходит за рамки нормы.
Признаки, симптомы и последствия повышения уровня кальция
Можно сказать, что разнообразие и тяжесть патологических симптомов отражают степень гиперкальциемии. Если при умеренной гиперкальциемии, когда уровень кальция в сыворотке / плазме колеблется в пределах 2,60-3,00 ммоль/л, патологические симптомы практически не проявляются, то при увеличении этого показателя > 3,50 практически всегда появляются клинические симптомы и признаки, которые могут носить угрожающий жизни характер.
Из желудочно-кишечных симптомов наиболее часто встречаются тошнота, рвота и запор. Со стороны центральной нервной системы наблюдаются такие нарушения нейропсихического состояния, как сонливость, депрессия и спутанность сознания. Могут также возникать психозы, судорожные припадки и даже кома. Обычны мышечная слабость и повышенная утомляемость. Сердечно-сосудистые проявления включают аритмии, имеющие характерные проявления на ЭКГ. При увеличении уровня кальция > 3,50 ммоль/л существует вероятность остановки сердца, поэтому необходимы срочные мероприятия по коррекции гиперкальциемии.
Частый признак умеренно тяжелой гиперкальциемии — неспособность почек эффективно концентрировать мочу, что проявляется полиурией (увеличением объема мочи) и полидипсией (жаждой). Длительно сохраняющаяся гиперкальци- емия, даже если она умеренная, может приводить к отложению кальция в почках с тенденцией формирования камней. Длительное компенсаторное усиление почечной функции может закончиться развитием почечной недостаточности.
Признаки, симптомы и последствия понижения уровня кальция
Умеренная гипокальциемия (уровень общего кальция в крови с поправкой на альбумин находится в диапазоне 1,802,20 ммоль/л) может не проявляться клинически. При более тяжелой гипокальциемии обязательно возникают симптомы тетании вследствие увеличения нервно-мышечной возбудимости. К ним относятся повышенная нервная чувствительность, ощущения покалывания в онемевших участках тела, болезненные мышечные спазмы и подергивания; в тяжелых случаях — конвульсии и судорожные припадки. Ларингеальные спазмы мешают нормальному дыханию, а при тяжелой гипокальциемии могут угрожать жизни пациента.
К проявлениям гипокальциемии относятся и сердечные аритмии с характерной картиной ЭКГ.
При длительно существующей гипокальциемии у больных наблюдаются такие нейропсихические симптомы, как сниженное настроение и психозы, а также повышается риск развития катаракты и сердечной недостаточности.
Признаки, симптомы и последствия повышения уровня фосфата
Не существует клинических симптомов, напрямую связанных с повышением концентрации фосфата в плазме крови, но сразу по нескольким механизмам это приводит к снижению уровня кальция в сыворотке / плазме. Поэтому у многих пациентов с гиперфосфатемией можно обнаружить симптомы гипокальциемии, описанные выше. Потенциально гиперфос- фатемия может приводить к отложению фосфата кальция в тканях — кальцификации.
Одно из важнейших последствий этого процесса — кальцификация артерий, затронутых атеросклеротическим процессом, что чревато коронарной недостаточностью и мозговым инсультом. Считается, что высокий риск кардиоваскулярной смерти у больных с хронической почечной недостаточностью обусловлен прежде всего гиперфосфатемией с последующей кальцификацией артерий, так часто встречающейся у больных из этой группы.
Признаки, симптомы и последствия понижения уровня фосфата
У большинства пациентов с гипофосфатемией содержание фосфата в плазме крови лежит в пределах 0,5-0,8 ммоль/л. При умеренном снижении нормального показателя редко обнаруживаются какие-либо патологические симптомы. Однако тяжелая гипофосфатемия (< 0,3 ммоль/л) манифестирует клинически. Основное ее проявление — мышечная слабость, которая может затрагивать мышцы, участвующие в акте дыхания. В ответ на снижение уровня АТФ может развиваться массивная деструкция мышц (рабдомиолиз). При дефиците фосфата в эритроцитах они разрушаются, что приводит к анемии. Со стороны центральной нервной системы могут наблюдаться такие симптомы, как спутанность сознания, судороги, редко — кома.