A. Причинение повреждений любого вида пациентам в результате регионарной анестезии нетипично; стойкие, инвалидизирующие повреждения крайне редки. Фактически низкая частота причиненных повреждений затрудняет изучение осложнений, связанных с регионарной анестезией, так как трудно накопить количество пациентов, достаточное для статистически достоверного анализа частоты, факторов риска, демографии и т. д. Самые большие исследования основаны либо на ретроспективном анализе наркозных карт, либо на добровольных сообщениях об осложнениях в центральную базу данных. Эти методы часто страдают предвзятостью (врачи могут не сообщать о своих серьезных осложнениях или пропускать мелкие, сочтя их слишком тривиальными и не заслуживающими сообщения), и в них в целом нет точности, деталей и результатов последующего наблюдения, необходимых для полной характеристики причин, факторов риска, восстановления и т. д. Даже большие проспективные исследования часто не позволяют задать правильный вопрос или проследить пациентов достаточно долго для идентификации поздно возникающих проблем. Например, Филипс с соавторами в проспективном исследовании 10 440 пациентов, получивших спинальную анестезию лидокаином не выявил того, что мы сейчас знаем как транзиторную неврологическую симптоматику (ТНС).
Б. Исследования на животных дали некоторую информацию о механизмах и факторах риска повреждений при регионарной анестезии, поскольку они позволяют исследователям воспроизводить реальные повреждения, а не ждать, пока они «случайно» произойдут в клинической практике. Конечно, животные — не люди, и при межвидовой экстраполяции количественных данных необходима осторожность. Тем не менее качественные соотношения, скорее всего, ценны, например наблюдение того, что риск повредить нерв в эксперименте на животных возрастает по мере увеличения дозы и концентрации местного анестетика.
B. С учетом этих предостережений, совсем недавно во Франции было проведено большое клиническое исследование осложнений, связанных с регионарной анестезией с использованием модели добровольных сообщений. Авторы собрали данные о 158 083 блокадах всех видов, выполненных 487 анестезиологами. Они сообщили о частоте серьезных осложнений (таких как судороги, повреждение центральных или периферических нервов, смерть), составившей 3,5 случая на 10 000 блокад. Риск смерти, по этим данным, составил 1/400 000 регионарных блокад, все случаи смерти, за исключением одного, имели место во время спинальной анестезии. В целом, доступные данные дают основания полагать, что регионарная анестезия сопровождается осложнениями не чаще, чем анестезия общая.
Повреждения местных тканей
А. Повреждение нерва. Все местные анестетики нейротоксичны и способны вызывать стойкие неврологические повреждения, если доза/концентра- ция достаточно высоки. Временные или стойкие повреждения тканей нерва, вызванные местными анестетиками (в противоположность повреждениям иглой), относятся к редким осложнениям регионарной анестезии. Выявлено множество факторов риска, и они включают:
1. Дозу/концентрацию местного анестетика. В эксперименте на животных риск нейротоксичности возрастал с ростом дозы и концентрации. Рекомендуемые дозы/концентрации местных анестетиков.
2. Адреналин. Добавление адреналина к местному анестетику повышает риск нейронального повреждения при периферических блокадах в эксперименте на животных. Является ли это результатом фармакокинетических эффектов адреналина (например, замедление выведения местного анестетика и, таким образом, удлинение времени воздействия его на нерв) или прямой токсичности — неясно.
3. Микроспинальные катетеры. Использование катетеров очень малого диаметра («микроспинальных») для длительной спинальной анестезии ассоциировалось с повреждением спинного мозга (синдром конского хвоста). Повреждение считается результатом того, что очень низкая скорость инъекции, достижимая с такими катетерами, приводит к ограниченному смешиванию местного анестетика со спинномозговой жидкостью (СМЖ); в связи с этим на ткань спинного мозга могут воздействовать очень высокие концентрации местного анестетика, особенно при использовании гипербаричных и гипобаричных растворов, которые могут скапливаться в нижележащих зонах субарахноидального пространства. Эти катетеры были запрещены в США Администрацией по лекарствам и пищевым продуктам (FDA) в 1992 г., но в других странах мира их продолжают использовать.
а. Важно отметить, что повреждение спинного мозга возможно и без применения интратекальных катетеров. В связи с этим, из соображений безопасности при «мозаичном» спинальном блоке лучше всего не увеличивать количество вводимого препарата, так как «мраморность» может означать, что у данного пациента распределение местного анестетика в субарахноидальном пространстве ограничено по неизвестным причинам. Повторение блокады может привести к очень высокой концентрации местного анестетика и неврологическому повреждению.
4. Растворы для обработки кожи. Все препараты, используемые для обеззараживания кожи перед выполнением регионарной анестезии, включая бетадин, хлоргексидин, спирт и другие, нейротоксичны. Необходимо соблюдать осторожность, чтобы исключить контаминацию местного анестетика каким-либо из этих растворов. Большинство коммерчески доступных «укладок» для регионарной анестезии включают отдельную емкость, в которую наливают антисептический раствор, перед тем как обмакнуть в него губку. Эту емкость необходимо вынуть из укладки и разместить в стороне от нее прежде, чем туда будет налит антисептик. Такая практика снижает риск попадания этих нейротоксичных растворов на иглы для регионарной анестезии или в раствор анестетика в результате разбрызгивания. Таким же образом и пакеты с заранее пропитанными антисептиком тампонами необходимо вскрывать в стороне от набора для регионарной анестезии во избежание контаминации.
5. Исходно существующие неврологические заболевания. Долгое время учи- ли/полагали, что пациенты, исходно страдающие неврологическими заболеваниями (рассеянным склерозом, периферической нейропатией, боковым амиотрофическим склерозом и другими), имеют повышенный риск неврологических повреждений во время регионарной анестезии. Это опасение было основано, по крайней мере частично, на концепции «удвоения разрушения», которая исходила из того, что второе повреждение нерва в другом месте может привести к повреждению большему, чем можно было бы объяснить простым аддитивным эффектом. Кроме того, естественное течение большинства этих заболеваний сопровождается чередованием ремиссий и обострений и может ухудшаться в результате стресса. Соответственно врачи боятся, что их могут обвинить в причинении вреда, тогда как фактически причина прогрессирования заболевания с анестезией никак не связана. Единственным большим исследованием (и = 139) влияния регионарной анестезии на пациентов с исходно существующими неврологическими заболеваниями был ретроспективный обзор пациентов с расстройствами ЦНС (постполиомиелитный синдром, БАС, PC и травма спинного мозга), получавших спинальную или эпидуральную анестезию. Авторы не нашли признаков новых неврологических повреждений или прогрессирования старых. Хотя это всего лишь ретроспективное исследование со всеми ограничениями, присущими исследованиям такого типа, оно дает основания полагать, что «традиционная мудрость» относительно регионарной анестезии у пациентов с исходно существующими неврологическими заболеваниями нуждается в дальнейшем изучении.
Б. Транзиторный неврологический синдром. ТНС подразумевает временную болезненность или дизестезию в ногах или ягодицах после спинальной анестезии. В основном проходит через 2—7 дней без последствий. Хотя ТНС могут вызвать все местные анестетики, риск при анестезии лидокаином выше, чем при использовании остальных анестетиков, и наиболее вероятен при артроскопии колена или других операциях, выполняемых в литотомическом положении. Механизм неизвестен, хотя считается — но не доказано, — что происхождение синдрома неврологическое. ТНС случается и при использовании низких концентраций лидокаина и даже при использовании низких доз, что заставило некоторых анестезиологов обращаться к альтернативным препаратам, несмотря на преходящий характер повреждения.
1. Тяжесть боли при ТНС для некоторых пациентов не тривиальна; по визуальной аналоговой шкале (ВАШ) боли 65% сообщают о боли от средней до тяжелой (ВАШ = 4—10). Но длится она все же не долго, 27% сообщают о сохранении симптомов в течение 3—7 дней.
В. Миотоксичность. Все местные анестетики вызывают дозозависимую мио- токсичность у всех пациентов, хотя бупивакаин представляется наиболее миотоксичным местным анестетиком. Механизм не вполне ясен, но было продемонстрировано нарушение функции митохондрий. При биопсии образца выявляются отек, некроз, апоптоз и воспалительная клеточная инфильтрация. Исследование на животных длительной (1—4 недели) инфузии местного анестетика для блокады бедренного нерва продемонстрировало кальцифицирующий мионекроз и формирование рубца. В качестве клинически идентифицируемой причины повреждения у людей местные анестетики выявляются очень редко: в первую очередь при ретробульбарных блокадах, вызывая дисфункцию экстраокулярных мышц с по- следующейдиплопией. Полноевосстановлениенормально.

Отсутствует корреляция между весом тела пациента и пиковой концентрацией в плазме после введения 400 мг лидокаина эпидурально. Такое же отсутствие взаимоотношения между весом пациента и пиковой концентрацией в плазме было у многих местных анестетиков и различных видах блокад. (С разрешения из: Brain DP, Scott DB. Dosage oflignocaine in epiduralblock in relationto toxicity. BrJAnaesth 1966;38:596.)
Г. Нейротравма. Исторически травма иглой и интраневральная инъекция считались важными причинами неврологического повреждения, что подтверждается и сегодня. Однако последние наблюдения с использованием УЗИ показали, что как прокол нерва иглой, так и интраневральная инъекция случаются и без заметных неврологических повреждений. Исследования на животных также показали, что преднамеренная интраневральная инъекция не обязательно приводит к перманентному повреждению, если давление инъекции было низким (менее 12 psi), и вызывает тяжелое повреждение при высоком давлении. Прокол периферических нервов иглой для блокад и интраневральная инъекция местных анестетиков сами по себе неприятны, и их следует избегать. Однако они могут быть событиями не такого большого риска, как это принято думать. В поиске способов снизить и так небольшую частоту повреждений нервов во время регионарной анестезии следует выявить дополнительные потенциальные факторы риска. Два аспекта локализации нерва были рассмотрены для предотвращения нейротравмы:
1. Нейростимуляторы, парестезии и нейротравма. Нейростимуляторы были введены в практику в качестве альтернативы использованию парестезии для локализации периферических нервов. Предполагалось, что величина тока, нужная для того, чтобы вызвать моторную реакцию, коррелировала с близостью кончика иглы к нерву и что использование такого нейростимулятора снизит риск повреждения нерва в результате контакта с иглой. Однако два исследования за последние несколько лет продемонстрировали, что корреляция между близостью иглы к нерву и током, нужным для вызова моторной реакции, невелика. При помощи УЗИ показано, что стимуляция нерва не способна вызвать моторную реакцию на ток менее 0,5 мА у25% пациентов, даже когда кончик иглы находился в контакте с нервом. У этих пациентов для вызова моторной реакции потребовались токи до 1,0 мА, даже когда игла находилась в контакте с нервом. Еще более удивительным был тот факт, что в этом же самом исследовании было найдено, что контакт иглы с периферическим нервом не способен вызвать парестезию в течение 62% времени. Таким образом, удивляет факт, как часто блокирующая игла прокалывает нерв во время попыток его локализации с использованием парестезии или нейростимулятора в качестве ориентира. Ни нейростимулятор, ни парестезия не служат надежными указателями близости иглы к периферическому нерву.
2. УЗИ и нейротравма. Заманчиво считать, что использование УЗИ для визуализации целевого нерва во время установки иглы и инъекции препарата снизит риск повреждения нерва, связанного с травмой. Однако для того, чтобы убедиться, так ли это, необходимы дополнительные исследования.
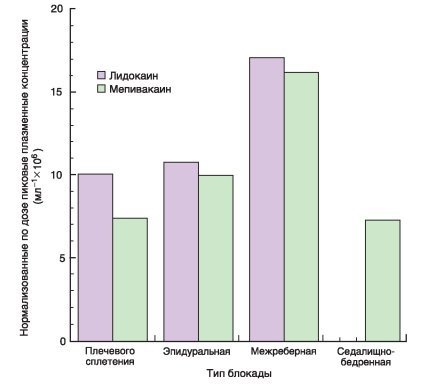
Нормализованные по дозе пиковые плазменные концентрации лидокаина и мепивакаина после различных типов блокад. Наибольшие концентрации образуются после межреберных блокад
Системная токсичность
Системная токсичность манифестирует в первую очередь в ЦНС и сердечнососудистой системе, хотя аллергия также может вызывать системные реакции. Токсическое действие на ЦНС и сердечно-сосудистую систему зависит от пиковой концентрации местного анестетика в плазме; системные аллергические реакции — нет.
А. Фармакокинетика токсичности
1. Большинство случаев токсического действия на ЦНС и, вероятно, все случаи серьезного токсического воздействия на сердечно-сосудистую систему бывают следствием непреднамеренного внутрисосудистого введения.
2. Пиковая концентрация местного анестетика в плазме варьирует приблизительно линейно с дозой, так что если вы удвоите дозу местного анестетика пациенту, то удвоите и его пиковую концентрацию в плазме.
3. Пиковая концентрация в плазме не зависит от веса тела у взрослых. Обоснование максимальной дозы местного анестетика на весе взрослого пациента не доказано научно и, таким образом,
неприемлемо с медицинской точки зрения (за исключением педиатрии). Тем не менее применение доз больших, чем рекомендовано производителем, сопряжено с медицинско-правовым риском.
4. Временные параметры и размахи пиковой концентрации в плазме варьируют в зависимости от выполняемого типа блокады, вероятно, в связи с различиями локальной васкуляризации и поверхности зоны абсорбции препарата. Учитывая вариабельность пиковой концентрации в плазме в зависимости от выполняемого типа блокады, неприемлемо (с точки зрения системной токсичности) применять одинаковые максимально рекомендованные производителем дозы при всех видах блокад. Тем не менее превышение максимальных доз, рекомендованных производителем, сопряжено с медико-правовым риском.
5. Ответственность за системную токсичность лежит на свободной (не связанной с белком) фракции местного анестетика, так как только несвязанный препарат может покидать плазму и переходить в ткани,
а. Ацидоз (метаболический или респираторный) смещает местные анестетики из их точек связывания с белком плазмы, таким образом повышая риск токсичности.
6. Адреналин замедляет абсорбцию и снижает пиковую концентрацию местного анестетика в плазме при большинстве типов блокад, противодействуя локальной вазодилатации, вызываемой местным анестетиком. Эффект сильнее выражен у более гидрофильных препаратов короткого действия.
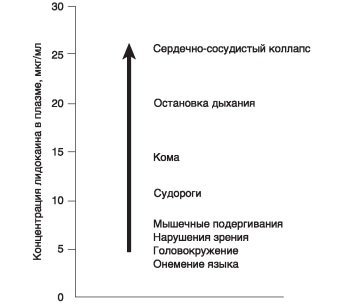
Симптоматика токсического действия местного анестетика стереотипно прогрессирует, независимо от свойств местного анестетика, до тех пор, пока концентрация в плазме растет относительно медленно. Очень быстрый рост плазменной концентрации может привести к «скачку» некоторых симптомов. Премедикация, особенно включающая седативные/гипнотические препараты, способна модифицировать картину (например, замедлить развитие судорог) или затруднить способность пациента сообщить о симптомах
7. Среди эфиров хлорпрокаин и прокаин вызывают системные токсические реакции с наименьшей вероятностью благодаря их относительно быстрому метаболизму холинэстеразой плазмы. Среди амидов прило- каин вызывает системные токсические реакции с наименьшей вероятностью благодаря своему относительно экстенсивному перераспределению (большой объем распределения) и относительно быстрому метаболизму в печени.
8. Благодаря своей значительно более медленной абсорбции гидрофобные препараты, такие как бупивакаин и этидокаин, с меньшей вероятностью вызывают системную токсичность, чем лидокаин — исключая случаи внутрисосудистого введения.
9. При использовании нескольких местных анестетиков их токсичность аддитивна, т. е. смешивание двух разных местных анестетиков не уменьшает риск токсичности.
10. Часто один энантомер местного анестетика менее токсичен, чем другой. Например, левовращающий изомер бупивакаина менее токсичен, чем правовращающий.
Б. Токсическое действие на ЦНС
1. Если концентрации местного анестетика в плазме растут достаточно медленно (например, при абсорбции из тканей), пациенты последовательно проходят через воспроизводимые в эксперименте стадии неврологических нарушений. Если концентрации в плазме растут быстро (например, при внутрисосудистом введении), первым проявлением токсичности могут быть судороги.
2. Соотношение терапевтических доз и доз, оказывающих токсическое действие на ЦНС, одинаково у всех местных анестетиков, и различий в их способности вызывать судороги нет.
3. Премедикация седативными гипнотиками (например, бензодиазепина- ми, пропофолом и барбитуратами) повышает судорожный порог и, вероятно, во многих случаях предотвращает судороги, которые без такой премедикации у пациента могли бы развиться.
4. Лечение. Лечение заключается в первую очередь в поддержании проходимости дыхательных путей для предупреждения гипоксии и, при необходимости, в поддержке сердечно-сосудистой системы до тех пор, пока концентрация в плазме не снизится ниже судорожного порога. Важно отметить, что гиперкарбия и ацидоз, вызванные судорогами, вытесняют местные анестетики из зон связывания с белками плазмы и потенциально усугубляют токсичность (т. е. продляют судороги, сердечно-сосудистую токсичность). Следовательно, прекращение то- нических/клонических судорог имеет потенциальную ценность. Судороги можно быстро прекратить седативными/гипнотиками (например, бензодиазепинами, барбитуратами) либо выключить ихмоторный компонент (который служит источником гиперкарбии и метаболического ацидоза) мышечными релаксантами (самый быстродействующий препарат — сукцинилхолин).
В. Токсическое действие на сердечно-сосудистую систему
1. Очень высокие дозы местного анестетика в плазме, необходимые для провоцирования серьезной сердечно-сосудистой токсичности, вероятно, могут быть достигнуты только при внутрисосудистом введении.
2. Терапевтическое/кардиотоксическое соотношение ниже у гидрофобных местных анестетиков (например, этидокаина, бупивакаина), чем у более гидрофильных препаратов.
а. Различие в относительной миокардиальной токсичности между гидрофильными и гидрофобными местными анестетиками обусловлено, по крайней мере отчасти, результатом частотнозависимого блока. Между сокращениями миокарда местные анестетики могут диффундировать из своих зон связывания в натриевых каналах миокарда, так, что при возникновении следующей деполяризации натриевый канал сможет проводить Na+ нормально. Поскольку гидрофильным местным анестетикам нужно меньше времени для диссоциации из зон связывания в натриевых каналах, выше вероятность, что натриевые каналы миокарда будут функционировать нормально при физиологической частоте сокращений сердца (ЧСС) под действием гидрофильных местных анестетиков, чем гидрофобных.
3. Сердечно-сосудистая токсичность манифестирует злокачественными дисритмиями, включая фибрилляцию желудочков, и/или беспульсовой электрической активностью (БЭА).
4. Лечение
а. Дисритмии не следует лечить лидокаином или любым другим местным анестетиком. Амиодарон широко не изучен, но представляется лучшим выбором для лечения дисритмий, вызванных местными анестетиками.
б. Исследования на животных продемонстрировали, что стандартные протоколы расширенной сердечной реанимации не адекватны для лечения БЭА, вызванной местными анестетиками. Адреналин необходимо вводить чаще и в значительно больших дозах. Следует подумать о применении кальция для противодействия глубокой вазодилатации и нарушениям контрактильности, связанным с очень высокими концентрациями местных анестетиков в плазме, вызывающими сердечно-сосудистую токсичность. Бикарбонат может быть эффективен в условиях метаболического ацидоза, так как помогает предупредить вытеснение местного анестетика из зон связывания с белками плазмы.
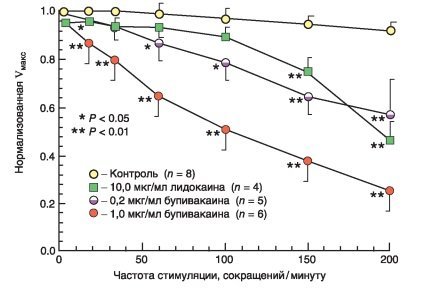
Влияние лидокаина и бупивакаина на скорость потенциала действия кардиомиоцитов (Vмакс), зависящее от частоты сердечных сокращений. Бупивакаин прогрессивно снижает VMaKC при частоте сердечных сокращений выше 10 уд./мин вследствие аккумуляции блока натриевых каналов, в то время как лидокаин не снижает ее до тех пор, пока ЧСС не превышает 150 уд./мин. (С разрешения из: Clarkson CW, Hondegham LM. Mechanisms forbupivacaine depression of cardiac conduction: fast block of sodium channels during the action potential with slow recovery fromblock during diastole. Anesthesiology 1985:62:396.)
в. Интралипид. Исследования на животных и ограниченный опыт у людей продемонстрировали, что интралипид эффективен при лечении сердечно-сосудистой токсичности, вызванной местными анестетиками. Исследования in vitro на изолированном сердце дают основания полагать, что интралипид изменяет гидрофобный характер крови, что способствует выведению гидрофобных местных анестетиков из миокарда в плазму.
(1) Доза. 1 мл/кг интралипида 20%-го болюсно с переходом на инфузию 0,25 мл/кг/мин. Болюс можно повторить дважды. Максимальная общая доза не должна превышать 8 мл/кг.
(2) Дантролен необходимо постоянно иметь под рукой для лечения редких случаев злокачественной гипертермии, но современные данные свидетельствуют о том, что и флакон интралипида разумно иметь для лечения сердечно-сосудистой токсичности, вызванной местными анестетиками.
5. Профилактика системной токсичности
а. Следует использовать наименьшие из возможных дозы местного анестетика.
б. Вводить местные анестетики необходимо медленно и дробно, чтобы иметь возможность распознать внутрисосудистое введение до того, как будет введена токсическая или фатальная доза.
в. Тест-доза. Применение тест-дозы для идентификации внутрисосудистого введения — возможно, отдельный и наиболее важный шаг в профилактике сердечно-сосудистой токсичности и токсичности ЦНС. Было предложено множество типов тест-доз.
(1) Применение препаратов, способных оказать влияние на ЦНС при случайном внутрисосудистом введении, например местные анестетики, опиоиды. Этот подход хорошо работает у не седа- тированных людей, предупрежденных о том, чего можно ожидать, но премедикация мидазоламом делает симптомы внутрисосудистого введения местных анестетиков ненадежными.
(2) Кардиоактивные препараты (например, адреналин, норадреналин) добавляют к местным анестетикам в связи с тем, что они вызывают объективные сердечно-сосудистые эффекты (повышение ЧСС и/или АД) при внутрисосудистом введении. Рекомендуемая тест-доза составляет 3 мл раствора местного анестетика, содержащего 15 мкг адреналина (1:200 000 = 5 мкг/мл). Показано, что повышение ЧСС на 20 уд./мин, развившееся в течение 2 мин после введения этой тест-дозы, со 100%-й чувствительностью и 100%-й специфичностью указывает на внутрисосудистое введение у молодых взрослых. Таким образом, тест-доза 15 мкг адреналина — прекрасный индикатор внутрисосудистого введения, если иметь в виду следующие предостережения:
(а) Величина прироста ЧСС снижается с возрастом пациента, особенно старше 40. Фактически у некоторых пожилых пациентов ЧСС может не отреагировать на 15 мкг адреналина. Реакция АД с возрастом меняется незначительно.
(б) Реакция ЧСС снижается, если не исчезает совсем, у остро ^-блокированных пациентов. В этой группе реакция систолического АД (аі-адренергический эффект) — более надежный индикатор внутрисосудистого введения.
(I) Влияние хронической p-адренергической блокады на гемодинамическую реакцию в ответ на адреналинсодержащую тест-дозу не известно.
(II) Влияние адреналин-содержащей тест-дозы на пациентов, получающих p-блокаторы плюс антигипертензивные вазодилататоры (т. е. блокаторы ангиотензин- превращающего фермента и ангиотензин-11 рецепторов) не известно.
(в) Реакция ЧСС и АД снижается у анестезированных пациентов. У таких ациентов, как и у остро р-блокированных, систолическое АД служит более надежным индикатором внутрисосудистого введения адреналин-содержащей тест дозы, чем ЧСС.
(3) Изменения зубца Т. Было показано, что снижение амплитуды зубца Т (25% или 0,1 мВ) является надежным индикатором внутрисосудистого введения адреналин-содержащей тест-дозы. Недостаток этого способа в том, что часто бывает трудно адекватно оценить количественные изменения зубца Т «на лету», по имеющемуся ЭКГ-монитору.
(4) Воздух. Было показано, что выслушивание шума «мельничных жерновов» над правым предсердием/желудочком является эффективным индикатором внутрисосудистого введения. Этот тест, по-видимому, наиболее полезен в родах, так как схватки могут продуцировать гемодинамические изменения, имитирующие реакцию на адреналин-содержащую тест-дозу.
Аллергия
Риск аллергических реакций на местные анестетики-эфиры невысок, а на местные анестетики-амиды крайне низок. Множество случаев «аллергии» на местные анестетики, по-видимому, есть результат того, что пациенты ошибочно принимали за аллергические реакции побочные эффекты, например, внутрисосудистое введение, тахиаритмии, индуцированные адреналином, вазовагальные реакции и т. д.
A. Эфиры. Большинство аллергических реакций на местные анестетики- эфиры, по-видимому, есть реакции на их общий метаболит, парааминобензойную кислоту (ПАБК). Это объясняет перекрестную аллергию между разными местными анестетиками-эфирами. Пациентам с аллергией на ПАБК (часто присутствует в косметике и кремах для загара), по- видимому, не следует применять местные анестетики-эфиры.
Б. Амиды. Документированные случаи аллергии на амиды крайне редки. Перекрестной аллергии между эфирами и амидами, по-видимому, нет.
B. Диагноз. При подозрении на аллергическую реакцию можно набрать кровь для измерения эстеразы плазмы, которая в основном повышается при развитии «истинной» аллергической реакции. Для проспективного выявления пациентов с аллергией на местные анестетики можно выполнить кожное тестирование.
Токсичность, не связанная с местными анестетиками
Опасность непреднамеренного введения токсических химикатов обусловлена постоянной близким расположением химикатов для подготовки кожи (бетадин, хлоргекседин) и местных анестетиков для блокад нервов. Описаны случаи непреднамеренного введения других токсинов, находящихся в операционной (например, формальдегид для хранения биопсийного материала), вызвавших повреждения и смерть. Другая опасность — применение периферических, эпидуральных и интратекальных катетеров для длительной инфузии препарата. Все, что только можно вообразить (пропофол, тиопентал, интралипид, антибиотики, мышечные релаксанты), непреднамеренно вводили в эти катетеры в операционной или хирургическом отделении, перепутав катетер с системой для внутривенной инфузии — иногда с серьезными последствиями.
А. Для снижения рисков непреднамеренного ввода:
1. Катетер или его коннектор должны быть промаркированы четко видимой этикеткой.
2. Для присоединения катетеров, доставляющих анестетик эпидурально и к периферическим нервам, к инфузионным помпам следует применять трубки, которые невозможно перепутать с внутривенными, и без боковых портов для доступа в систему.
3. К катетеру нельзя подключать «краники».
4. Необходимо постоянно обучать медсестер госпитальных отделений, в чью обязанность входит введение лекарств.
Осложнения, связанные с кровотечением
Практически все периферические и центральные нейроаксиальные блокады сопровождаются хотя бы незначительным кровотечением. Кровотечения с формированием гематом могут затруднить пальпацию анатомических ориентиров, но, как правило, не существенны. Однако эпидуральные или интратекальные гематомы могут привести к драматическим последствиям. Расширение применения профилактики тромбоэмболий в периоперационном периоде повышает этот риск. Американское общество регионарной анестезии и лечения боли провело обзор рисков, связанных с выполнением регионарной анестезии пациентам, получающим антикоагулянты, и опубликовало рекомендации, разместив их на сайте (www.asra.com), которые можно считать наиболее современным источником информации в данной области.
А. Коагулопатии. Ятрогенные (гепарин, кумадин, ингибиторы тромбоцитов и т. п.), самоиндуцируемые (гинкго, чеснок и жень-шень) или возникающие в результате болезненных процессов, — все коагулопатии представляют собой самый главный фактор риска осложнений, связанных с серьезным кровотечением. У пациентов, полностью антикоагулированных, следует избегать регионарной анестезии, особенно эпидуральной и спинальной, за исключением случаев, когда очевидные преимущества перевешивают опасность.
1. Нестероидные противовоспалительные препараты (НПВП). При отсутствии других дефектов свертывающей системы НПВП не влекут существенного повышения риска образования гематом.
2. Низкие дозы нефракционированного гепарина. «Минидозы» или гепарин подкожно для тромбопрофилактики не сопряжены с повышением риска эпидуральной гематомы при введении дважды в день.
3. Сообщения о клинических случаях дают основания полагать, что удаление катетера у антикоагулированного пациента может представлять такой же высокий риск, как и его установка. Таким образом, решение о возможной антикоагуляции во время или после операции надо рассмотреть до установки эпидурального катетера.
а. Установка эпидурального катетера пациенту, который впоследствии будет полностью антикоагулирован гепарином (например, при операциях на сердце или сосудах), безопасна при следующих условиях.
(1) От установки катетера до антикоагуляции должно пройти не менее 1 ч.
(2) Приняты меры для того, чтобы катетер был удален не ранее нормализации коагуляционного статуса пациента.
(3) Операция отменяется, если зафиксирована свободная аспирация крови. «Травматичная блокада» может считаться фактором, повышающим риск гематомы, но следует заметить, что рекомендация отменять операцию была применена только 4 пациентам в оригинальной серии из4011 случаев.
(4) Пациенты не принимают никаких других антикоагулянтов, например, НПВП.
Б. Эпидуральная/интратекальная гематома. Редкое, но потенциально драматическое осложнение. Установленная частота — менее 1:150 000 центральных нейроаксиальных блокад.
1. Факторы риска. Кроме антикоагуляции множественные попытки и/или травматичное введение иглы имели место приблизительно в 50% зарегистрированных случаев.
2. Проявления. Чаще всего проявляется моторной слабостью и/или утратой чувствительности, которые бывает трудно отличить от длительной послеоперационной анестезии. Боль в спине не является уникальным проявлением. Часто симптомами проявляются более чем через 24 ч по- еле выполнения блокады. Любая неожиданная слабость служит показанием к немедленному неврологическому исследованию, включая диагностическую визуализацию (предпочтительна магнитно-резонансная томография, аксиальная компьютерная томография приемлема), поскольку необходимо неотложное вмешательство.
3. Лечение. Есть сообщения о нескольких случаях успешного консервативного (безоперационного) лечения; однако быстрое (менее 8 ч с момента появления симптоматики) хирургическое удаление гематомы остается методом выбора. Скорость и степень восстановления зависят от скорости удаления гематомы.
Инфекция
Инфекция нетипична. Факторы риска включают иммунокомпрометирующие состояния, наличие вживленных катетеров и длительность их стояния, неприменение антибиотиков периоперационно. Хотя специальных исследований не было, выполнение блокад через инфицированные ткани, вероятно, повышает риск инфекционных осложнений и его следует избегать.
A. Блокады периферических нервов. Риск инфекции, вызванной периферической блокадой «одной инъекцией» с надлежащим соблюдением правил асептики, крайне низок. Риск инфекции или колонизации возрастает при использовании постоянных катетеров. И все же, несмотря на частую колонизацию катетеров (приблизительно 70%; главным образом Staphylococcus epidermidis), клинические признаки инфекции встречаются редко (менее 3%).
Б. Центральные нейроаксиальные блокады. Риск инфекции в результате эпидуральной или спинальной блокады, выполненной «одной инъекцией», низок, хотя, вероятно, выше, чем при блокадах периферических нервов. Частота менингита после спинальной анестезии оценивается как менее 1:40 000, а риск абсцесса после эпидуральной анестезии — менее 1:10 000.
1. Факторы риска
а. Как и катетеры, доставляющие анестетик к периферическим нервам, эпидуральные катетеры повышают риск эпидурального абсцесса.
б. Данные экспериментов на животных дают основания полагать, что нелеченная бактериемия повышает риск менингита после люмбальной пункции. При адекватной антибиотикотерапии люмбальная пункция не повышала риск менингита в условиях бактериемии. Неизвестно, характерно ли это для людей.
в. Хориоамнионит. Имеющиеся к настоящему времени данные исследований дают основания полагать, что хориоамнионит в послеродовом периоде не приводит к повышению риска инфекционных осложнений регионарной анестезии родов.
B. Симптомы инфекции. При периферических инфекциях можно ожидать появления локальной болезненности, эритему, лихорадки и лейкоцитоза. Менингит обычно проявляется лихорадкой, головной болью, фотофобией, менингизмом и, позднее, изменением ментального статуса. Эпидуральный абсцесс часто проявляется болью в спине и/или корешковыми болями, которые могут быть невыраженными. Сенсорные/моторные изменения могут быстро прогрессировать до паралича.
Г. Лечение. Инфекции, связанные с периферическими катетерами, в основном излечиваются удалением катетера и антибиотикотерапией, соответствующей результатам посева. Эпидуральный абсцесс и менингит относятся к неотложным состояниям, с высоким процентом летальности/осложнений. Необходимо агрессивное консервативное и/или хирургическое лечение.