Рассеянный склероз (РС) — издавна известное человечеству заболевания. Сегодня можно сказать, что это вторая (после черепно-мозговой травмы) по распространенности болезнь, которая поражает центральную нервную систему (ЦНС) у молодых людей в наиболее продуктивный период их жизни, снижая качество жизни не только пациентов, но и их родственников.
История. Первый случай РС был описан только в 1395 До нас дошла гравюра, на которой изображена молодая девушка по имени Лидвина (1380-1433) из городка Шайдаму (рис. 1). Катаясь на коньках, девушка упала, после чего развилась болезнь, которая продолжалась 38 лет и была тщательно задокументирована. После смерти больного были обнаружены признаки, соответствующие настоящем диагноза РС.

Рис.1 Первая гравюра РС
Следующее упоминание о РС в истории произошло в 1833, когда Август Фредерик д’Эсте (1794-1848), внук Британского короля Георга ИИИ и кузен королевы Виктории, в 1822 заболел болезнью, симптомы которой он тщательно описывал в своем дневнике (рис. 2). Так, был описан неврит зрительного нерва и двоение, слабость в ногах, нарушение функции тазовых органов, прогрессировали и приковали больного к постели в конце жизни. Ретроспективно был диагностирован РС.
В XIX веке профессор анатомии Robert Carswell (1793-1857) и анатом Jean Cruveilhier (1791-1857) описали «странную» патологию спинного мозга независимо друг от друга. R. Carswell напечатал свои иллюстрации в 1838 году. И, таким образом, считается первым ученым, который описал патанатомия РС. Между тем Jean Cruveilhier впервые задокументировал историю болезни пациентки с РС и согласовал клинические проявления и морфологические признаки. В 1849 г.. Friedrich von Frerichs в своей работе «Склероз мозга» предоставил характеристику клиническим симптомам РС. Karl von Rokitansky (1804-1878) исследовал очага РС под микроскопом и определил «жирные тела» в 1857.
В 1863 г.. Еduard Rindfleisch сделал значительный вклад в патофизиологии РС. Он открыл, что хроническое воспаление является ответственным за демиелинизации. Анализ накопленных к тому времени данных позволил французскому неврологу Jean-Martin Charcot достичь нового уровня в клиническом смысле РС. Он показал корреляции между патологией и симптомами, и в 1868 были напечатаны его открытия под названием «Histologie de la sclerose en plaques». Вскоре Pierre Marie, студент J.-M. Charcot и его преемник в госпитале Сальпетриер, предположил, что инфекция вызывает РС.
В 1904 г.. Немецкий терапевт Adolf von Strumpell описал такие проявления РС, как насильственный плач и смех без причины. Otto Marburg, председатель Неврологического института Венского университета, в 1906 описал особую форму РС, которая была названа по его имени. Это наиболее агрессивный вариант течения болезни, в основе которого, по мнению автора, — действие яда, разрушает миелин.
В 1913 г.. Диагностика и дифференциальная диагностика РС стали более надежными благодаря проведению спинномозговой пункции и исследованию ликвора. Было определено, что более чем у 95% пациентов с РС интратекальный синтез антител может быть обнаружен путем исследования олигоклональных групп иммуноглобулинов.
В 1933 г.. Thomas River, невролог Института Рокфеллера в Нью-Йорке, разработал модель РС на животных, исследуя вакцины. Вследствие инъекции свободных от вирусов клеток, сенситизованих к собственному миелина, у мышей развивалась болезнь, похожая на РС, — экспериментальный аутоиммунный энцефаломиелит. В 1947 г.. Elvin A. Kabat из отделения неврологии Колумбийского университета подтвердил иммунологический компонент в патогенезе РС, исследуя ликвор методом электрофореза.
В 1950 г.. Первый пациент был эффективно пролеченных АКТГ, а в 1972 г.. — Был внедрен новый метод диагностики — зрительные вызванные потенциалы, которые позволили выявлять аномалии проведения импульсов зрительным нервом и зрительными путями. В 1978 г.. компьютерная томография позволила прижизненно выявлять очаги демиелинизации, а в 1980-х гг. Она была заменена на магнитно-резонансную томографию — более точный и информативный метод нейровизуализации.
Эпидемиология. РС — это хроническое воспалительное и аутоиммунное заболевание ЦНС, главной чертой патогенеза которого является демиелинизация. В мире сегодня насчитывается около 2300000 таких больных, по данным статистики Минздрава, в Украине их около 20 тыс. За последние десятилетия количество больных росло быстрее, чем в предыдущие годы XX века. Это объясняют несколькими причинами. С одной стороны, ухудшаются экологические условия в определенных регионах, с другой — улучшается ранняя диагностика заболевания и выявления таких больных уже по первым его признаками. Прогресс фармацевтической промышленности и изобретения лекарств, модулируют течение ремитирующего варианта болезни, улучшение реабилитации и социальной помощи позволили увеличить в конечном итоге продолжительность жизни больных РС.
Распространение РС неодинаковое в разных регионах. Редко эта болезнь встречается в странах, расположенных близко к экватору, но с удалением от него на север и на юг количество таких больных возрастает. В Северной Европе, Соединенных Штатах Америки, Австралии распространенность этого заболевания превышает 100 на 100 тыс. Населения (рис. 3); в Южной Европе и Северной Африке — от 10 до 60 человек на 100 тыс. Почти не болеют РС в тропических странах — Экваториальной Африке, Китае, Японии, Индии (менее 10 на 100 тыс.), особенно редко болезнь встречается у чернокожих африканцев. В разных регионах Украины она колеблется от 28 до 90 человек на 100 тыс. Населения, с преобладанием распространенности в западных и северных регионах.
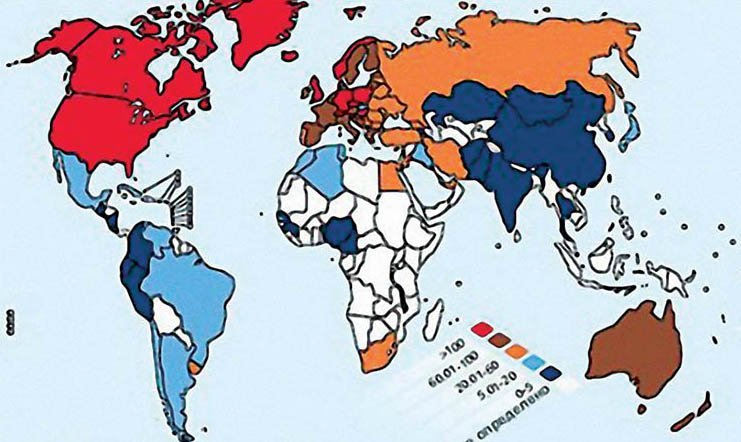
Рис. 3 распространенность склероза на 100 тыс. населения
Уже в середине XX века стало известно, что географический фактор имеет большое значение для развития болезни. Изменение человеком места жительства до 15 лет своей жизни на зону с меньшим риском заболевания уменьшала степень риска заболеть РС. Переезд после этого возраста уже не влиял на риск возникновения болезни.
Болеют преимущественно люди в возрасте от 15 до 40 лет. У большинства пациентов заболевание начинается в 30 лет. В 1,5-2 раза чаще мужчин болеют женщины. Это заболевание не относится к наследственным, но частота РС в семьях среди родственников в 15-25 раз превышает общую частоту в популяции. Чаще оно наблюдается в многодетных семьях. Есть доказательства генетического риска (λs = ~ 40): если риск РС в популяции составляет 0,1%, в кровных родственников — 2-4%, в двуяйцовых близнецов — 5%, а у однояйцевых равна уже 30%.
Этиология. Сегодня нельзя сказать, что этиология РС полностью известна, хотя за последние годы наука значительно приблизилась к раскрытию этого вопроса. Наиболее доказанной является мультифакторная теория развития РС, по которой истек нескольких факторов — эндогенных и экзогенных — обусловливает начало и дальнейшее течение болезни.
К эндогенным относят генетические факторы, точнее речь идет о полигенную обусловленность болезни. Именно генетические факторы определяют низкий порог активности различных типов клеток приобретенного и врожденного иммунитета, в том числе Тh17, В-клеток и макрофагов. Но главными среди них являются гены главного комплекса гистосовместимости (Major Histocompatibility Complex, MHC), также известного как человеческий лейкоцитарный антиген (Human Leukocyte Antigen — HLA), которые расположены на 6 хромосоме и отвечают за иммунный ответ организма на любые антигены. С наибольшим риском развития РС ассоциированы определенные полиморфизмы, в частности HLA-DRB1 * 1501 (коэффициент достоверности составляет 3,0).
Среди экзогенных факторов значительное внимание уделяют вирусам, триггерная роль которых допускается при активации иммунопатологического процесса. Сегодня научные исследования сконцентрировались вокруг вирусов герпеса группы, которые склонны к длительной персистенции в организме человека и могут быть одним из антигенов при образовании тримолекулярного комплекса и активации иммунокомпетентных клеток. Так, немалое внимание уделяется вируса Эпштейна-Барр (EBV), который имеет близкий к основному белку миелина (ОБМ) эпитоп: EBV-пептид — HLA-DR2a, ОБМ-пептид — HLA-DR2b. Это может быть основанием для перекрестной иммунной реакции по механизму молекулярной мимикрии, результатом которой становится разрушение миелиновой оболочки. Кроме того, определено, что люди, которые болели инфекционным мононуклеозом, вызываемое EBV, имеют в пять раз выше риск заболеть РС.
Еще один вирус, который претендует на роль триггера, — вирус герпеса 6 типа (HHV6). Вирус високотропний к клеткам как нервной, так и иммунной систем. Вирусы HHV6A и HHV6B встречаются повсеместно среди взрослого населения и сейчас ассоциируются с РС. Они находятся в латентном состоянии в клетках периферической крови, слюнных желез и могут интегрироваться в теломеры хромосом. У пациентов с РС определяется повышенный уровень вирусной ДНК с коинфекцией HHV-6A / 6B.
Сегодня показана роль и другие факторы внешнего окружения для развития и течения РС. В последнее время большое внимание уделяется витамина D, так адекватное его получения с пищей или в результате солнечного облучения ассоциируется со снижением риска развития РС. Показано, что влияние достаточного уровня витамина D на эмбрион может быть эффективным предупредительным для развития РС в будущем, а подростковый период является наиболее важным и чувствительным для обеспечения протективного роли этого витамина (например, в виде дополнительного рыбьего жира). Наибольший связь уровня витамина D и течения РС показан для пациентов с положительным локусом HLA-DRB1 * 1501.
Вопрос особенностей питания больных РС всегда было в центре внимания как врачей, так и пациентов. Пока нет доказательств, что какие-либо диеты ассоциированные с риском развития болезни. Есть отдельные данные, что ожирение в подростковом возрасте у женщин повышает риск развития РС. Но более убедительными результаты последних исследований, которые подтверждают, что употребление чрезмерного количества соли приводит к активации патологического процесса при наличии РС. Так, постоянное увеличение потребления натрия более 2 г в день достоверно повышает количество обострений и образования новых очагов на МРТ в 2,5 раза, а свыше 4,8 г в день — в 3,4 и 3,6 раза соответственно. Механизмы этого раскрыты в последние годы: показано, что соль индуцирует секрецию интерлейкина (ИЛ) 17А и экспрессию митохондриальной РНК, оказывает негативное влияние на ход иммунопатологического процесса.
В последние годы изучается влияние курения на течение РС. Доказано, что эта привычка увеличивает риск РС (отношение шансов (ОШ) ~ 1,6) и имеет дозозависимый эффект — риск повышается с увеличением накопленной дозы (ОШ до 3). Даже после отказа от курения в течение 5 лет сохраняется повышенный риск развития этой болезни. Страдают не только активные курильщики, но и пассивные, у них риск также увеличивается (ОШ 1,3-1,8). Негативное воздействие курения реализуется через воздействие на иммуномодулирующие свойства Т- и В-лимфоцитов.
Патогенез РС достаточно сложный. Он состоит из нескольких последовательных этапов, каждый из которых переходит в следующий, и в то же время все эти процессы находятся вместе в различных отделах ЦНС. Схематично патогенез выглядит так. Начинается патологический процесс в периферической крови, где происходит активация аутореактивных CD4 + клеток при формировании тримолекулярного комплекса. Активирующими агентами могут выступать вирусы нейроспецифические белки — фрагменты ОБМ, протеолипидным протеина (ПЛП), миелинолигодендроцитарний гликопротеин (МОГ) и др. Известно, что вирусы имеют короткие аминокислотные последовательности, которые схожи с фрагментами (эпитопами) некоторых белков, в частности нейроспецифических. Поэтому благодаря молекулярной мимикрии иммунные клетки могут активироваться как против чужеродных вирусных агентов, так и против собственных белков миелина. Активируются и В-клетки, которые образуют антитела к антигенам, в том числе противовирусные и протимозкови. Активированные клетки проходят через гематоэнцефалический барьер (ГЭБ), чему способствует экспрессия молекул адгезии на поверхности клеток эндотелия сосудов и Т-лимфоцитов при участии матриксных металлопротеиназ.
В мозга активированные иммунные клетки взаимодействуют с клетками глии — астроцитами и микроглией — и в результате реактивации производят провоспалительные цитокины (ИЛ-1, ИЛ-2, γ-интерферон — γ-ИФН, лимфотоксин — ЛТ, фактор некроза опухолей-α — ФНО α), что приводит к развитию ограниченной воспалительной реакции и следующей за ней демиелинизации. При этом предполагается взаимодействие не только с собственными аутоантигенами, но и с посторонними агентами, в частности вирусом, встроенный в мембрану олигодендроцитов или миелина. Механизмы демиелинизации при РС разные: это может быть макрофагально-ассоциированная или антитело-индуцированная демиелинизация, или вызвана первичной олигодендроцитарною дегенерацией. Не последнее место в развитии патологических процессов занимает образования активных метаболитов кислорода и развитие оксидантного стресса, который является общим механизмом поражения нервной системы при наличии различных заболеваний нервной системы.
В дальнейшем образуются клоны патогенных клеток и антител, развивается множественная демиелинизация, повреждаются олигодендроциты. Это приводит к вторичной аксональной дегенерации с атрофией головного и спинного мозга, наиболее выражено при прогредиентного течения РС. Таким образом, РС является не только воспалительным и демиелинизирующим заболеванием, но и дегенеративным. Дефектные участки замещаются астроцитарной пулом клеток с образованием склеротических бляшек. Кроме того, имеются значительные потери нейронов: по данным МРТ, уменьшается объем хвостатого ядра, происходит очаговое истончение церебральной коры.
Вместе с процессом демиелинизации наблюдается также ремиелинизацию, пролиферация незрелых олигодендроцитов, в возникновении которой большое значение имеют нейротрофические факторы (нейротрофины, цитокины, трансформирующие и инсулиноподобный фактор роста). Но, к сожалению, миелин в таких очагах ремиелинизацию нельзя назвать полноценным как в морфологическом плане, так и в функциональном.
Иммунопатологические, воспалительные и демиелинизирующие процессы сопровождаются нейродегенеративными изменениями и гибелью аксонов, имеет ведущее значение в прогрессировании РС и возникновении необратимой инвалидизации больных.
Преимущественно очага или бляшки локализуются в участках перивентрикулярного пространства, зрительных нервов, ствола головного мозга, мозжечке, в боковых и задних канатиках спинного мозга.
Клиническая картина. Выделяют несколько вариантов течения РС: ремитирующий (РРС), вторично-прогрессирующий (ВПРС) и первично-прогрессирующий (ППРС). РРС характеризуется чередованием обострений и ремиссий. Во время обострения у пациента возникают новые симптомы или усиливаются существующие, и эти симптомы содержатся более 24 ч при отсутствии инфекции или любой другой причине. Именно обострения связаны с образованием активных очагов воспаления в веществе мозга. Ремиссии могут быть полными, когда симптоматика обострений исчезает полностью, или неполными, если остается неврологический дефицит после выхода из обострения. В начале заболевания ремиссии, как правило, бывают полными, а иногда — спонтанными, то есть обострения завершается без лечения. Но со временем тяжесть обострений возрастает, а ремиссии становятся неполными. Нужно подчеркнуть, что во время ремиссий патологические процессы в организме больного не прекращаются, несмотря на отсутствие клинической активности заболевания.
Через несколько лет РРС трансформируется в ВПРС. Постепенно обострения прекращаются, а болезнь начинает прогрессировать, и в мозге доминируют дегенеративные процессы. В среднем половина больных переходят в ВПРС через 10 лет болезни.
Небольшой процент пациентов имеют изначально прогрессирующий вариант течения болезни — ППРС (10-15%). Неврологическая симптоматика постепенно растет, иногда с периодами стабилизации. При таком варианте течения в мозге также преобладают дегенеративные процессы, которые плохо поддаются лечению. ППРС обычно начинается в относительно пожилом возрасте, после 40 лет, распределение мужчин и женщин почти равный, в неврологическом статусе доминирует нижний спастический парапарез.
В последние годы отдельно выделяют клинически изолированный синдром (КИС), что, по сути, соответствует термину «дебют заболевания». Фактически это первое обострение РРС, которое может быть моносимптомним или полисимптомним и в отличие от острого рассеянного энцефаломиелита не сопровождается нарушением сознания, повышением температуры тела и психическими расстройствами. Чаще КИС выступает как ретробульбарный неврит (РН), поперечный миелит, синдром неуклюжей руки. Как правило, на МРТ уже в это время выявляются множественные очаги демиелинизации.
Необходимо назвать еще один особый вариант течения РС — агрессивный, или вариант Марбурга. В 1906 г.. А. Марбургом был описан крайне быстрый ход РС у молодой женщины, которая умерла за месяц. Сегодня к такому варианту относятся бурное течение болезни, которое приводит к смерти пациента за 1 год. В мозгу такого больного развивается массивная воспалительная демиелинизация с привлечением всех отделов и преимущественным поражением ствола мозга.
Нарушение проводимости импульсов по демиелинизованих путях ЦНС обусловливает развитие неврологической симптоматики, которая бывает очень разнообразной. Центральные парезы и параличи вследствие поражения пирамидных путей наблюдаются в развернутой картине РС почти у всех больных. Сначала это парапарезы нижних конечностей, но со временем присоединяются парезы рук и развиваются трех- и тетрапарез. Расстройства координаторной функции могут быть результатом поражения мозжечка с появлением триады Шарко (интенционный тремор, нистагма и скандированная языка), а также мозжечковой атаксии в позе Ромберга и при ходьбе. Координаторные нарушения могут возникать и в результате поражения путей глубокой чувствительности, преимущественно в задних канатиках. В таких случаях наряду с нарушением суставно-мышечной и вибрационной чувствительности будет наблюдаться сенситивная атаксия. Очень часто у пациента присутствуют оба вида атаксии — и мозжечковая и сенситивная.
У трети больных РС начинается с поражения зрительных нервов или глазодвигательных нарушений. Пациенты обращаются к офтальмологу с жалобами на боль и резкое снижение остроты зрения на один, редко — оба глаза, которое длится от одного до 3-4 недель. Диагностируется РН, который связан с возникновением очагов демиелинизации в зрительном нерве. У большинства больных через несколько недель зрение начинает улучшаться и зрительная функция может полностью восстановиться. После перенесенного РН на глазном дне формируется побледнение или атрофия височной половины диска зрительного нерва.
Глазодвигательные нарушения чаще проявляются нистагмом и межядерною Офтальмоплегия. Характерным в начале заболевания является монокулярный нистагм, но при условии поражения мозжечка наблюдается грубый бинокулярное нистагм. Нередко возникает двоение в глазах, которое обычно связано с поражением медиального продольного пучка в стволе мозга и является результатом межядерной офтальмоплегии.
Различные нарушения чувствительности является типичным симптомом РС. В первую очередь это парестезии в различных участках тела, нередко в виде утягивающие корсеты на груди или животе. Часто встречается и симптом Лермитта — ощущение прохождения электрического тока вдоль позвоночника сверху вниз во время сгибания шеи. Боль также частым симптомом у больных РС. Обычно это боли в инвалидизированные пациентов и в старших возрастных группах, сопровождающие парез (так называемый боль от слабости — pain of weakness), или повышение мышечного тонуса (spasticity pain). На боли, связанные с спастикой, жалуются больше половины больных РС пожилого возраста с длительным течением болезни и более 6,0 баллов инвалидизации по шкале Куртцке (J. Kurtzke). У больных с РРС боли связаны с обострениями, которые привлекают сенсорные проводники. Такие болевые ощущения иногда продолжаются еще несколько месяцев после обострения, могут сопровождаться тоническими мышечными спазмами.
Головные боли нередко встречаются в клинической картине РС, даже на ранних стадиях болезни. Полностью их причины не ясны, но учитывают ликвородинамическими нарушения, сосудистый фактор, напряжение мышц шеи. Отдельную группу составляют больные с РС и прозопалгичним синдромом, в котором на первом месте регистрируется невралгия тройничного нерва.
Почти у всех больных с РС периодически возникают нарушения мочеиспускания чаще по центральному типу вследствие демиелинизации пирамидных и ретикулоспинального путей. Гиперактивность детрузора, которая возникает при этом, проявляется императивными призывами к мочеиспусканию. Возможно сочетание таких нарушений с периодическими задержками мочеиспускания вследствие детрузорно-сфинктерных диссинергией.
Вслед за нарушениями мочеиспускания возникает сексуальная дисфункция, которая фиксируется и у мужчин, и у женщин. Степень сексуальных расстройств коррелирует с выраженностью неврологического дефицита и в меньшей степени с продолжительностью болезни. Страдают не только отдельные составляющие сексуальной функции (либидо, нарушения оргазма и т.д.), но и отношения между сексуальными партнерами.
Активное изучение когнитивной сферы в последние годы показало, что она нарушается уже на самых ранних этапах РС. Выявить это можно с помощью нейропсихологического тестирования. У небольшой части больных фиксируются признаки легкой деменции, подобной лобно-подкорковой. Субстратом для таких нарушений могут быть как множественные очаги демиелинизации в полушариях, так и атрофические процессы в мозге.
Еще один характерный для РС симптом — усталость — встречается более чем в 2/3 больных. Этот симптом значительно отягощает состояние пациентов, нарушая их повседневную активность. Усталость может возникать или усиливаться после нагрузки и уменьшаться после отдыха, то есть иметь миастенического составляющую, но может быть постоянной и мешать пациенту выполнять простейшие действия.
Несколько реже при РС отмечаются эпилептические припадки и другие пароксизмальные состояния, но возможны и случаи слияния двух отдельных заболеваний — РС и эпилепсии.
Известны и другие симптомы и феномены РС. Это клиническая диссоциация между морфологическим состоянием структур и их функциональными возможностями, ухудшение состояния больных РС при повышении внешней температуры, нестабильность отдельных симптомов в течение дня. Эти симптомы не имеют самостоятельного диагностического значения, но при наличии рассеянной неврологической симптоматики могут дополнить клиническую картину.
Диагностика. Критерии диагноза РС в XIX в., Когда J.-M. Charcot описал клинические признаки заболевания, базировались только на данных клиники. В ХХ в. клинические характеристики были дополнены лабораторными и нейровизуального. В ХХI в. произошла систематизация диагностических критериев с учетом новых возможностей. Итак, современный диагноз РС базируется на комплексе критериев, таких как клинико-неврологические, анамнестические, лабораторные и нейровизуального.
Клинико-неврологические критерии учитывают багатовогнищевисть поражения ЦНС по данным топической диагностики, то есть «диссеминации в пространстве», поражение «типичных» систем и структур и поэтапное возникновения очагов — «диссеминации во времени».
Анализируя конституционно-анамнестические данные , обращают внимание на возраст пациентов: начало болезни в возрасте от 16 до 45 лет является наиболее типичным для РС. Важным основанием для диагностики признаки хронизации заболевания с багатовогнищевистю неврологической симптоматики, наличие в анамнезе эпизода неврологического дефицита, который возобновился в течение 3-4 недель, или симптоматика непрерывно растет или ремитуе течение нескольких месяцев.
Лабораторные критерии в зависимости от цели можно объединить в группы:
I — подтверждение наличия факторов риска РС:
исследования генетических маркеров HLA-системы и тому подобное;
определение олигоклональных иммуноглобулина G (Ig G) в спинномозговой жидкости, наличие которого согласно современным взглядам имеет диагностическое значение лишь для ППРС;
II — определение активности иммунопатологического процесса:
функционального состояния иммунной системы, реакции подавления миграции лейкоцитов с нейроспецифические белками, показателей клеточного сенсибилизации к нейроспецифических белков, уровня аутоантител к ним, иммунологические тесты первого и второго уровня для контроля начального статуса и мониторинга терапии;
цитокинового и интерферонового статуса для определения степени воспалительного процесса: содержание в крови и ликворе ФНО-α, трансформирующего фактора роста-β, ИЛ-10, растворимых форм межклеточных молекул адгезии (ICAM) и молекул адгезии клеток сосудов (VCAM), количественное определение общего сывороточного интерферона и интерфероногенный способности лейкоцитов
III — определение метаболических нарушений, уровня ненасыщенных и полиненасыщенных жирных кислот, процессов перекисного окисления липидов и др.
Методы нейровизуализации: МРТ с мощностью магнитного поля не менее 1 Тесла — обнаруживает множественные очаги демиелинизации в белом веществе головного мозга в перивентрикулярных пространствах, вокруг рогов и вдоль тел боковых желудочков (рис. 4), в мозолистом теле с характерным признаком в виде «пальцев Доусона»(рис. 5), в стволе мозга и мозжечке, в зрительных нервах, в спинном мозге обычно на уровне шейных и верхнегрудных сегментов (рис. 6). Спинальные очаги имеют следующие особенности. Они сигарообразные (в сагиттальном разрезе), размером до 2-3 сегментов длиной, охватывают часть диаметра спинного мозга с эксцентричным локализацией. Редко оказывается масс-эффект.
Рис.4
Рис.5
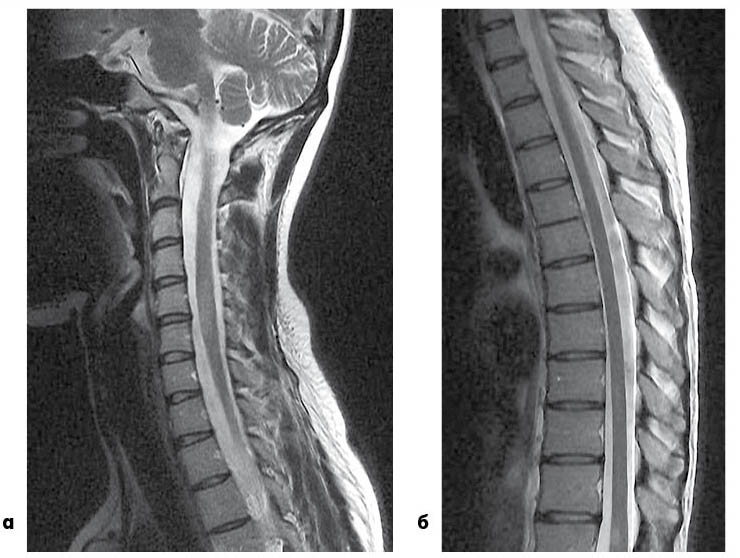
Рис.6
Очага на МРТ гиперинтенсивные в Т2-взвешенном изображении (ОС), в Т1 изображении — изо- или гипоинтенсивни. Хронические очаги со стойкой утратой аксонов могут визуализироваться как «черные дыры» (рис. 7). Размеры очагов могут быть разными — более характерны для РС очага размером> 3-4 мм. Накопление очагами контрастного вещества, которое содержит препараты гадолиния, подтверждает активность процесса (рис. 8).
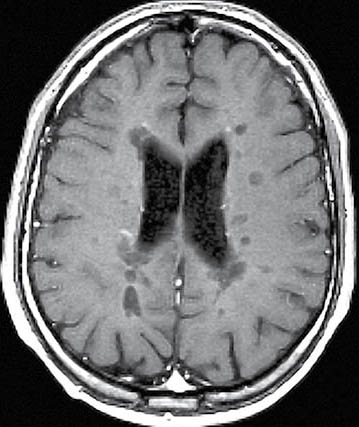
Рис. 7
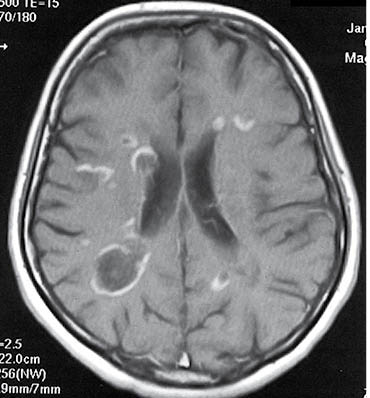
Рис. 8
В диагностике РС используют вызванные потенциалы головного и спинного мозга различной модальности — зрительные, сомато- сенсорные, слуховые и тому подобное. Они помогают подтвердить наличие очагов демиелинизации, в частности субклинических — тех, которые не определяются при обследовании неврологического статуса. Этот метод позволяет также определить степень поражения проводящих путей и динамику их изменений во время лечения (рис. 9).
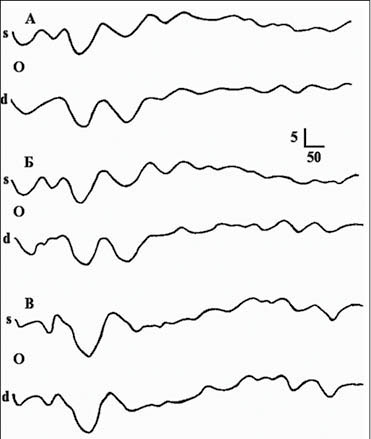
Рис. 9 потенциалы головного и спинного мозга различной модальности А — острая стадия, Б — месяц, В — через 5 месяцев
Сегодня диагноз РС базируется на критериях WI McDonald и соавт. Они учитывают объективное подтверждение диссеминации очагов как во времени, так и в пространстве, объединяют МРТ-изменения с клиническими и другими параклинических данных (вызванные потенциалы, показатели ликвора), облегчают постановку диагноза при различных типах РС, включая моносимптомний, типичный ремитирующий и постоянно прогрессирующий, без явных атак и ремиссий. По этим критериям выделяют три варианта диагноза РС, возможно РС (в случаях риска РС, но при сомнительном диагнозе) и отсутствие РС.
- Параклинические доказательства диагноза РС:
* Доказательства диссеминации в пространстве:
> 1 Т2 очага на МРТ в минимум двух из четырех областей ЦНС: перивентрикулярной, юкстакортикальний, инфратенториальных или спинном мозге
накопления контраста не требуется для диссеминации в пространстве
если пациент имеет симптомы поражения ствола мозга или спинного мозга, эти очаги исключаются из подсчета.
** Доказательства диссеминации во времени: - новые Т2 и / или очага, которые накапливают контрастное вещество, на следующей МРТ относительно предыдущей, независимо от срока проведения МРТ
или - одновременное присутствие на МРТ бессимптомных очагов, накапливающих и не накапливают контраст в любое время обследования (рис. 10).
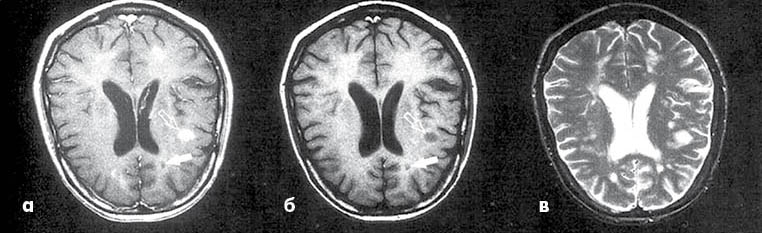
Рис. 10
Именно последний критерий позволяет значительно ускорить диагностику РС на ранних этапах заболевания. Сегодня очевидна бесспорная необходимость быстрой и ранней диагностики РС благодаря известным возможностям превентивной иммуномодулирующей терапии, начало которой на стадиях минимального неврологического дефицита позволяет замедлить инвалидизацию и улучшить качество жизни больных РС.
Степень неврологического дефицита оценивают по расширенной шкале оценки степени инвалидизации Expanded Disability Status Scale (EDSS). Шкала учитывает состояние различных функциональных систем: зрительной, двигательной, чувствительной, координаторной, тазовых органов, стволовые функции, изменения интеллекта. По сумме баллов от каждой системы рассчитывают общий балл инвалидизации. Проведение периодической оценки балла EDSS позволяет контролировать степень и скорость прогрессирования инвалидизации пациента.
Дифференциальная диагностика РС заслуживает отдельной статьи. В типичных случаях заболевание молодых людей с необходимыми данными дополнительных методов диагноз не вызывает затруднений. Но иногда, особенно в начале заболевания, бывает нужна дифференциальная диагностика с инфекционными, сосудистыми, дисметаболическими, наследственными, системными заболеваниями соединительной ткани, опухолями и т.д.
Современные принципы терапии РС можно объединить в два положения. Во-первых, рекомендуется раннее начало лечения при минимальной инвалидизации пациента, во-вторых, лечение назначается в соответствии с течения и стадии РС.
В стадии обострения РРС бесспорная эффективность показана для терапии ГКС по схеме пульс-терапии большими дозами коротким курсом: внутривенное капельное введение 1 г в сутки метилпреднизолона в течение 3-5 дней. Для предупреждения развития негативных явлений со стороны желудочно-кишечного тракта можно назначить ингибиторы желудочной секреции. В первые годы заболевания альтернативой кортикостероидов может быть проведение плазмафереза. Эффективность противорецидивной терапии лучшая в первые дни — до двух недель обострения. Первые легкие обострения могут исчезать самостоятельно, без лечения, с развитием так называемой спонтанной ремиссии. Возобновление сначала бывают полными, но со временем такая терапия помогает все меньше. Поэтому актуальным становится вопрос предупредительной терапии с помощью препаратов, которые меняют ход РРС. Такое лечение начинают в стадии ремиссии и продолжают длительным и непрерывным курсом, обычно годами.
К препаратам первой линии терапии относят β-интерфероны 1b и 1а и глатирамера ацетат (ГА), которые имеют уровень доказательности А (класс 1). b-интерфероны обеспечивают антигеннеспецифичний эффект: снижают уровень экспрессии антиген молекул HLA-системы, подавляют пролиферацию Т-клеток и активность макрофагов, снижают уровень экспрессии молекул адгезии на эндотелиальных клетках, повышают продукцию противовоспалительных и подавляют действие провоспалительных цитокинов. ГА относится к препаратам антигенспецифичнои терапии и обеспечивает конкуренцию и замену белков миелина (ОБМ, МОГ, ПЛП) в механизме антигенпрезентации при взаимодействии с молекулами HLA II класса, создает ГА-специфические Т-супрессорные клетки, которые перекрестно реагируют с ОБМ, а также адекватно влияет на продукцию цитокинов. Такие эффекты не происходят в одночасье, и реально оценить эффективность лечения можно только за 6-8 месяцев. Критериями оценки служат такие показатели, как отсутствие обострений или по крайней мере уменьшения их частоты, тяжести и продолжительности, приостановления или уменьшения скорости прогрессирования устойчивых неврологических нарушений, которые обусловливают инвалидность, а также по данным МРТ — отсутствие образования новых очагов и углубления нейродегенеративных изменений. Препараты первой линии сегодня хорошо изучены и широко используются во всем мире, не исключая и Украину, благодаря государственной программе обеспечения больных РС.
Но не у всех больных врачи видят достаточный положительный результат такого лечения, поэтому нередко возникает вопрос о необходимости эскалации терапии. Неудачной считается терапия, если у больного развивается 2 обострения в год или 3 обострения за 2 года, происходит увеличение показателей EDSS на 2 балла за год. Вместе с тем дискутабельним остается вопрос увеличения очагов на МРТ без признаков повышенной клинической активности. Предлагается не менять лечение, если образуется 2-3 новых очага в течение 1-2 лет. Предикторами неудачной терапии препаратами первой линии, в частности интерферонами, могут быть разные причины, например, образование нейтрализующих антител к препарату. Сегодня активно разрабатывается направление соединения науки и передовых технологий, который позволит определить биомаркеры чувствительности или, возможно, толерантности к тем или иным препаратам, но широкое применение этих данных впереди. Поэтому в случае неэффективности лечения вышеуказанными препаратами пока речь идет о целесообразности перевода больных на вторую линию терапии.
Такой переход показан тем, у кого происходили рецидивы (более одного за предыдущий год терапии) и образовались 9 и более новых T2 очагов или более одного очага, накапливающих контрастное вещество. Также лечение препаратами второй линии изначально показано пациентам со стремительным развитием болезни, тяжелым РС, с> 2 инвалидизирующими рецидивами в год и вышеупомянутыми изменениями на МРТ.
К препаратам второй линии принадлежат моноклональные антитела — специфические антитела (иммуноглобулины), которые позволяют ограничить патологическую активность отдельных групп (клонов) клеток, например цитотоксических CD20, 25 т. В Украине зарегистрирован натализумаб, который является гуманизированным моноклональное антитело к одной из молекул адгезии (альфа-4 бета-1-интегринов) на поверхности Т-лимфоцитов, которые отвечают за прикрепление лимфоцитов к эндотелию сосудов во время проникновения через ГЭБ. Препарат таким образом блокирует выход активированных лимфоцитов из сосудистого русла к очагу воспаления в ЦНС назначается в качестве монотерапии для введения с интервалом 4 недели.
Это позволяет достичь значительной эффективности, практически вдвое большей по препараты первой линии, особенно у больных с тяжелым течением РС. Он уменьшает количество обострений у 68% пациентов в течение первого года, риск прогрессирования болезни — у 54% больных, положительно влияет на МРТ-картину, уменьшая воспаление, количество новых и активных очагов демиелинизации. Но такое лечение требует контроля за состоянием противовирусного иммунитета, в частности к полиомавирусов JCV (John Cunningham virus, вирус Джона Каннингема), активация которого в случае иммуносупрессии (предварительной или вследствие длительного применения натализумабу) приводит к возникновению прогрессирующей мультифокальной лейкоэнцефалопатии. Это тяжелое поражение ЦНС с нарушением координации, зрения, речевых функций, тяжелыми когнитивными расстройствами имеет плохой прогноз для жизни, большинство больных умирают, потому что эффективных средств лечения этой болезни пока не существует.
Другой препарат второй линии, зарегистрированный в Украине, — Финголимод — относится к модуляторов рецептора сфингозин-1-фосфата (S1P). Он препятствует выходу аутореактивных лимфоцитов из лимфоузлов и уменьшает, таким образом, проникновение этих лимфоцитов в ЦНС. Результатом является снижение частоты обострений на 52% по сравнению с препаратами группы интерферонов и на 30% замедление прогрессирования инвалидизации. Таблетированная форма (0,5 мг в сутки) является удобной для пациентов, но лечение начинают под контролем врача с ежечасным регистрацией артериального давления, пульса, ЭКГ в связи с возможным развитием брадиаритмии и AV блокады 1-й степени. Из возможных отдаленных побочных эффектов следует назвать снижение числа лимфоцитов периферической крови, макулярный отек через несколько месяцев лечения. Были зафиксированы случаи герпетического энцефалита, поэтому перед началом лечения у пациентов определяют наличие антител к вирусу Herpes zoster.
В случаях агрессивного течения РС назначают митоксантрон по традиционной схеме (обычно в дозе 12 мг / м2 внутривенно 1 раз в 3 месяца) или сочетание митоксантрона и метилпреднизолона. Широкий спектр побочных эффектов цитостатиков (лейкопения, кардиотоксичность, гепатотоксичность) ограничивает их использование у больных РС.
В литературе можно найти работы, посвященные применению внутривенного иммуноглобулина для лечения как обострений, так и более длительного во время ремиссий, но пока что доказательная база для такого лечения окончательно не сформирована.
В случае прогрессирующего течения РС возможности эффективного лечения гораздо меньше. Это объясняют доминированием других патогенетических характеристик патологического процесса, а именно — нейродегенеративных и атрофических процессов, на которые пока существенно повлиять не удается. Используют пульс-терапию кортикостероидами, b-интерфероны, цитостатики, моноклональные антитела. Постоянно ведется поиск новых препаратов, способных не только прекратить воспалительный процесс в ЦНС, но и улучшить ремиелинизацию, уменьшить нейродегенерацию и стимулировать репарацию в ЦНС.
Симптоматическое лечение применяется во всех случаях при необходимости коррекции отдельных симптомов, таких как спастичность, боли, атаксия и тремор, дисфункция сексуальная и тазовых органов, пароксизмальные состояния, психические и когнитивные расстройства, повышенная утомляемость.
Симптоматическая терапия и медико-социальная реабилитация охватывают не только обновления двигательных и чувствительных функций, нормализации психического состояния, работоспособности, но и меры по максимально возможного возобновления социальной активности больного, поддержания его независимости, реального улучшения качества жизни, имеет важное значение в коррекции неврологических проявлений у больных РС.
Подводя итог, можно отметить основные черты проблемы РС сегодня. Во-первых, произошла смена «имиджа» РС, перевод его из разряда болезни-приговора в группу болезней с возможным контролем и коррекцией симптомов. Для этого необходимо и сегодня возможно раннее назначение терапии может изменить ход РС, иммуномодулирующих препаратов первой или при необходимости второй линии для сохранения стабильности клинической картины, предупреждения обострений и прогрессирования болезни. И наконец, последнее будет возможным при условии ранней диагностики РС по современным критериям на этапе РРС, когда такое лечение может быть эффективным. Немалая роль в определении группы риска РС отводится первом звене медицинской помощи — врачам общей практики — семейным врачам. Сейчас разработаны унифицированный клинический протокол оказания помощи больным РС на разных уровнях — первичных, вторичных и третичных учреждениях здравоохранения, в котором четко определены положения и необходимые действия врачей этих учреждений. Именно на первичном звене должны быть выявлены пациенты с подозрением на РС и своевременно направлены на дальнейшее обследование и уточнение диагноза. От скоординированности действий врачей всех звеньев и будет зависеть успешность оказания помощи отдельному больному и вообще таком контингента больных в стране.







