Альтернативой для срединной стернотомии при протезировании аортального клапана сегодня все чаще становится мини-стернотомия. Госпитальная летальность составила 8,5%. Умерло трое больных: двое — от прогрессирующих после операции сопутствующих заболеваний почек и легких, еще один — от возникшего расслоения аорты типа В. В трех пациентов возникла необходимость в конверсии на полную срединную стернотомию. Замена аортального клапана из мини-доступа имеет определенные преимущества для пациента, однако технически сложнее для хирурга. Нами описаны технические приемы, облегчающие хирургические манипуляции на аортальном клапане в ограниченном пространстве.
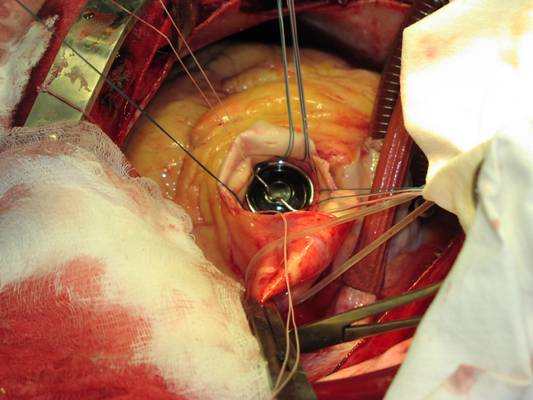
Тенденцией современной кардиохирургии стало выполнение операций протезирования или реконструкции клапанов сердца с мини-доступов. Все большее количество западных центров кардиохирургии считают стандартом для изолированного протезирования аортального клапана исключительно мини-стернотомию. Растет число хирургов, которые в своей индивидуальной практике каждую замену аортального клапана проводят только через мини-стернотомию. Публикации последних лет показывают, каким образом и через какие этапы произошел переход от полной срединной стернотомии в мини-инвазивных доступов как обязательного протокола в кардиохирургических клиниках целых стран.
Хотя мини-стернотомия еще не стала непременным элементом операции замены аортального клапана, рамки ее клинического применения расширяются, что требует уточнения технических приемов ее выполнения, потенциальных осложнений и путей их преодоления. Цель работы — проанализировать технические особенности использования верхнего мини-стернотомного доступа для протезирования аортального клапана.
Материалы и методы. Впервые мини-стернотомию для протезирования аортального клапана мы применили 15 января 2013. С этого момента по март 2016 аналогичным образом прооперировано 35 пациентов, что составило 15% всех изолированных протезувань аортального клапана за указанный период. Среди прооперированных пациентов было 19 мужчин и 16 женщин, средний возраст больных составил 63 ± 21 год. Сахарный диабет II типа выявлено в 11-ти, и типа — у одного, хроническое обструктивное заболевание легких — в 9-ти, метаболический синдром был у 6 пациентов. Фракцию выброса 35% и ниже обнаружили в 12-х человек, у остальных больных нарушения сократительной способности миокарда не было.
Имплантировали различные типы механических и биологических аортальных протезов. Техника имплантации протезов не отличалась от таковой при операциях, выполненных из-за полного стернотомию В 9-ти пациентов с узким кольцом аорты выполнили частичную транслокацию протеза в области некоронарного створки в восходящую аорту.
Для защиты миокарда у всех больных применили антеградную кровяную кардиоплегии через ячейки коронарных артерий. Деаэрацию левых отделов сердца осуществляли через восходящую аорту и крыша левого предсердия, у части больных дополнительно через правую верхнюю легочную вену.
Результаты и их обсуждение. Трое пациентов умерли в раннем послеоперационном периоде, госпитальная летальность составила 8,5%. Одна пациентка в возрасте 28 лет, со стенозом двустворчатого аортального клапана, с терминальной стадией хронической болезни почек на фоне пролонгированной программного гемодиализа, умерла на 20-е сутки после операции вследствие прогрессирующей почечной недостаточности, уремии, гиперкалиемии и уремического миокардита.
Другой больной в возрасте 72 года, с сопутствующим тяжелым хроническим обструктивным заболеванием легких, скончался на 7-е сутки в результате прогрессирующей дыхательной недостаточности. К использованию мини-стернотомии в обоих этих пациентов побудило стремление уменьшить травматичность операции, учитывая их тяжелое состояние и имеющиеся сопутствующие заболевания.
Еще один больной в возрасте 53 лет, с метаболическим синдромом, умер в результате ятрогенного осложнения во время операции — острого расслоения аорты типа В (Stanford). Причиной возникновения расслоения стала канюляция восходящего отдела аорты по методике Сельдингера, которая в момент выполнения выглядела технически неосложненной, однако, очевидно, сопровождалась вероятным повреждением зоны атеросклеротической бляшки на нисходящей грудной аорте ниже устья левой подключичной артерии. Из-за отсутствия ярких клинических проявлений данное осложнение было распознано только через 15 часов после операции на фоне уже возникшей контрактуры конечности с развитием прогрессирующей почечной недостаточности. У нас нет оснований считать, что канюляция аорты в условиях ограниченного операционного поля стала причиной расслоения аорты. Сама канюляция проходила без технических трудностей, а конструкция использованной в этом случае артериальной канюли Medtronic EOP с многочисленными боковыми отверстиями, казалось бы, наоборот, уменьшала риск расслоения стенки аорты единственным током крови.
У трех пациентов мы были вынуждены перейти из минидоступа в полной стернотомии: у одного из них — по причине глубокого размещения корня аорты и постстенотичного расширение восходящего отдела аорты, в другой — для обеспечения адекватной защиты миокарда путем ретроградной кардиоплегии.
У еще одного пациента конверсию выполнили в раннем послеоперационном периоде по поводу послеоперационного кровотечения. Источником кровотечения была ветвь правой внутренней грудной артерии в проекции прикрепления VI-VII ребер к грудине, которое оказалось недоступным для точной локализации и ликвидации мини-доступа.
С ростом количества операций из мини-доступа мы внедрили определенные приемы, которые увеличивают пространство для хирургических манипуляций. В частности, вместо J-образного разреза грудины, которым пользовались в течение первых 13 операций, теперь применяем Т-образную мини-стернотомию в IV межреберье с поперечным распилом грудины. Такой разрез, по нашему мнению, несколько увеличивает площадь операционного поля, улучшает визуализацию ствола легочной артерии, которая необходима для дренирования левых отделов сердца, и, вероятно, уменьшает травматическое нагрузки на края частично распыленной грудины.
Другим техническим приемом стало уборка с операционного поля венозной канюли. Сейчас для венозного дренажа используем согнутую под прямым углом однопросвитну Г-образную канюлю диаметром 36 Fr — 42 Fr, которую выводим не из операционное поле, а через отдельное отверстие в области мечевидного отростка справа. Это отверстие в конце операции используем для установки загрудинной дренажной трубки.
С целью увеличения площади операционного поля у одного пациента с постстенотичним расширением восходящего отдела аорты канюлювалы бедренные артерии и вену, при этом конец венозной канюли для увеличения венозного притока заводили в правое предсердие.
Деаэрацию выполняли путем активной аспирации через катетер, который вставляли в восходящий отдел аорты, и пункции правой верхней легочной вены под контролем чреспищеводной эхокардиографии.
Восстановление сердечной деятельности осуществляли путем внешней дефибрилляции, пластины дефибриллятора крепили к передней грудной стенки в проекции верхушки сердца и под левую лопатку.
Среди обязательных технических элементов выполнение операции с верхней мини-стернотомии есть нашивки миокардиального электрода для временной электрокардиостимуляции перед снятием зажима с аорты, еще на опустевших камерах сердца. Выполнить этот привычный прием после наполнения камер сердца технически невозможно, поскольку в рану прилегает только восходящая аорта. По аналогичным причинам и из-за опасности травмы сердца установку дренажных трубок выполняем в начале операции, еще до раскрытия перикарда.
Для уменьшения риска ранней послеоперационной тампонады сердца во всех раскрываем правую плевральную полость.
Выводы. Использование мини-стернотомного доступа в начале учебной кривой сопровождается снижением комфорта хирурга из-за ограниченности операционного поля. Использование определенных приемов разреза грудины и техники канюляции сердца позволяют увеличить пространство для хирургических манипуляций и убеждают хирургов в целесообразности широкого внедрения этой перспективной технологии.







