Ранние MALT-лимфомы обычно являются зависимыми от H. pylori и могут лечиться путем уничтожения бактерий с помощью антибактериальной терапии. Напротив, хромосомные транслокации, обеспечивающие автономный рост, могут возникать по мере развития лимфомы и могут сделать их независимыми от сигналов окружающей среды. Таким образом, механизмы, способствующие пролиферации опухолевых клеток, вероятно, весьма различны в ранних и поздних желудочных MALT лимфомах и поэтому обсуждаются отдельно.
Патогенез ранней, Helicobacter pylori-зависимой MALT лимфомы: роль Т-клеточных комумулирующих сигналов
есколько доказательств свидетельствуют о том, что «ранние» MALT лимфомы не растут автономно, но требуют активации активации и пролиферации клеток Т-хелпера. Многочисленные исследования показали, что опухолевые инфильтрационные Т-клетки обильны в массе MALT лимфомы (Knörr et al., 1999; Müller et al., 2005). Обнаружены как CD4 +, так и CD8 + Т-клетки с типичным соотношением приблизительно 4: 1. Проточный цитометрический и иммуногистохимический анализ биопсий человека, а также материала от экспериментально инфицированных мышей также показал, что инфильтрирующие Т-клетки активируются и экспрессируют активационный маркер CD69 (Knörr et al., 1999; Müller et al., 2005). Антигенспецифическая активация инфильтрирующих Т-клеток также демонстрируется их экспрессией CD40-лиганда, поверхностного маркера, который опосредует взаимодействие T- / B-клеток через CD40 на поверхности B-клеток (Knörr et al., 1999). Интенсивные опухоли Т-клетки в MALT лимфомах человека и MALT-лимфомальные поражения у мышей также экспрессируют маркер иммунокомпетентности CD28 (Knörr et al., 1999; Müller et al., 2005), другую поверхностную молекулу Т-клеток, которая взаимодействует с B7 Связанный с поверхностным белком CD80 на антигенпредставляющих клетках и передает костимулирующие сигналы, необходимые для полной активации Т-клеток при контакте с антигеном. Эти наблюдения повысили вероятность того, что H. pylori-специфические, активированные, инфильтрационные опухоли Т-клетки могут обеспечить сигналы роста к опухолевым В-клеткам.
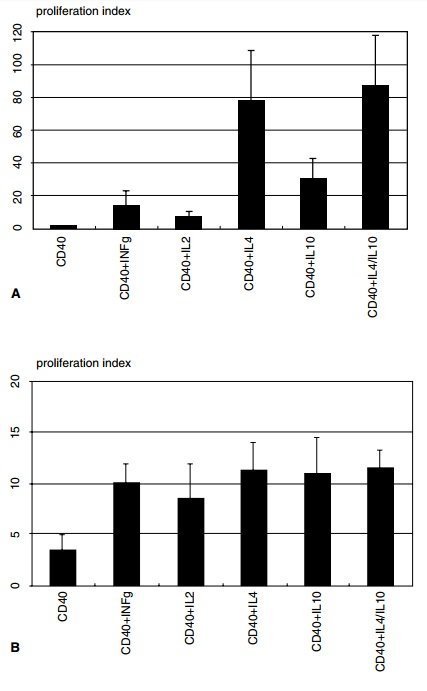
Роль Th2-цитокинов в патогенезе MALT-лимфомы. (A) и (B), Резюме низкосортной [(A) n = 6] и высокосортной (B) n = 5] MALT-лимфомы В-клеточной пролиферации, которая индуцируется анти-CD40 и цитокинами. В общей сложности 5 × 104 очищенных В-клеток культивировали в трех повторностях с цитокинами и без анти-CD40, как указано. В-клеточной пролиферации определяли на 5-й день культивирования путем добавления 3 H-тимидина, присутствующего в течение последних 16 часов культурального периода. Индекс пролиферации выражают в виде cpm assay / cpm medium. Результаты дают кумулятивное среднее значение для всех пациентов, рассчитанное на основе трех независимых тестов на пролиферацию, проводимых для каждого пациента. Каждая панель ошибок дает стандартное отклонение соответствующего кумулятивного среднего значения. (C) Фенотипическая характеристика опухолепроникающих иммунных клеток в мышиных лимфомах MALT. Последовательные криоизоляции окрашивались сине-серыми с моноклональными антителами против указанных антигенов и контрастировали с ядерным красным светом. Для ориентации ориентирован участок, покрытый гематоксилином и эозином.
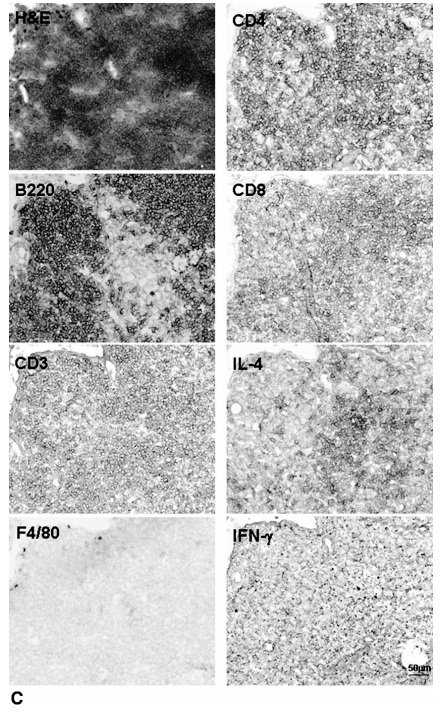
Лимфоидные агрегаты колонизируются CD3 + Т-клетками, но не F4 / 80 + макрофагами. B220 + В-клетки составляют преобладающий тип клеток. Интенсивные опухоли Т-клетки в основном являются CD4 + и продуцируют интерлейкин (IL) -4, но не интерферон (IFN) -g. Шкала масштаба включена в нижнюю правую панель. (A и B, перепечатанные из Greiner 1997, с разрешения Американского общества по расследовательской патологии, C перепечатано из Müller et al., 2005, с разрешения Американского общества по расследовательской патологии.)
Действительно, несколько исследований in vitro с использованием культур эксплантированных, несортированных опухолевых клеток показали, что их можно поддерживать в живых и индуцировать размножение путем добавления нагретого экстракт H.pylori (Hussell et al., 1993a, 1996). Истощение Т-клеток из культур отменяет пролиферацию, предполагая, что H. pylori-специфические Т-клетки играют важную роль в стимулировании пролиферации опухолевых клеток (Hussell et al., 1996). Интересно, что лигирование рецептора CD40 с помощью агонистического антитела может заменять Т-клетки в этом сценарии, предполагая, что для роста опухоли требуется прямое взаимодействие T- и B-клеток через CD40 (Greiner et al., 1997). Эта система культивирования дополнительно продемонстрировала, что цитокины, полученные из Т-клеток, типичные для Th2-подмножества, играют важную роль в пролиферации В-клеток, поскольку добавление IL-4 и IL-10, но не добавление Th1-цитокинов IFN-g или IL -2, усиливает эффект лигирования CD40 на выживаемость и пролиферацию опухолевых клеток (Greiner et al., 1997). Действительно, MALT лимфомы у людей и опухоли MALT-лимфомы у мышей, как было обнаружено, выражают высокие уровни Th2-цитокинов in vivo (Knörr et al., 1999; Müller et al., 2005), предоставляя дальнейшую поддержку роли Ответного ответа Th2 в MALT лимфомагенезе.
Интересно отметить в этом контексте, что только штаммы мыши с генетической предрасположенностью к поляризации Th2, такие как BALB / c, развивают MALT лимфомы при персистирующей экспериментальной инфекции видами Helicobacter. Штаммы с расстройством Th1, такие как C57 / Bl6, развивают связанные с Helicobacter патологиями в соответствии с требованием для Th1-предвзятых ответов Т-клеток, таких как хронический активный гастрит, изъязвление желудка и аденокарцинома желудка, но защищены от MALT лимфомы. Таким образом, Th2-поляризованные Т-клетки переводят специфичные к H. pylori сигналы в сигналы роста для ранних MALT лимфомы, которые сами по себе не являются специфичными для Helicobacter.
Специфичность MALT-лимфомы-продуцируующей иммуноглобулин
Клетки MALT-лимфомы переносят перегруппированные и соматически мутированные Ig-гены, подразумевая, что они получены из В-клеток с активированной антигеном. Коэффициенты замены против молчаливых мутаций в каркасных областях генов IgV значительно <1,5, что означает, что, несмотря на высокие частоты мутаций, селективные силы сохраняют рецептор В-клеток в MALT-MALT-лимфомах. Сообщалось о внутриклональных вариациях, вызванных текущими соматическими мутациями и / или замене части переменного тяжелого сегмента (рецепторная ревизия) (Du et al., 1996a, 1996b; Qin et al., 1997; Thiede et al., 1998). Поскольку клетки MALT-лимфомы экспрессируют функциональный Ig, их специфичность представляет большой интерес. Несколько неожиданно, многократные исследования показали, что опухоль Ig (который обычно генерируется гибридомной технологией) последовательно не распознает антиген H.pylori в Вестерн-блотах или в областях, подверженных иммуногистохимическому анализу. Напротив, было описано связывание иммуноглобулинов опухолевых клеток с различными структурами нормальных тканей человека (фолликулярные дендритные клетки, венулы, эпителиальные клетки, соединительная ткань) (Greiner et al., 1994; Hussell et al., 1993b). В соответствии с этой наблюдаемой автореактивностью опухолевых иммуноглобулинов обнаружено преимущественное использование определенных генов семейства VH, которые, как представляется, часто участвуют в производстве аутоантител (Du et al., 1996a; Qin et al., 1995).
В недавнем исследовании, сравнивающем структуру рецепторов антигенов большой группы немодгинских лимфомы зрелого B, MALT-лимфомы были уникальными в том, что значительная доля выраженных рецепторов B-клеточного антигена с сильной CDR3-гомологией с ревматоидными факторами (RFs ) (Bende et al., 2005). RFs являются антителами против Fc-части человеческого IgG, обнаруженной у пациентов с ревматоидным артритом; RFs и IgG образуют иммунные комплексы, которые являются частью процесса заболевания различных аутоиммунных заболеваний. Гомология RF-CDR3 иммуноглобулинов MALT-лимфомы без исключения включала остатки, кодированные N-областью в гипермутированных IgVH-генах, что указывает на то, что они были строго выбраны для реактивности с авто-IgG. Используя 10 антител, полученных из MALT-лимфомы, в исследованиях связывания in vitro было показано, что многие антитела с гомологией RF-CDR3 действительно обладают сильной РЧ-активностью (рис. 4.7A) (Bende et al., 2005). Ни одна из MALT-лимфомы с транслокацией (11; 18) не обладает гомологией RF-CDR3 или связыванием IgG in vitro, подтверждая, что MALT-лимфомы, несущие t (11; 18), не зависят от BCR-опосредованной активации NF-kB для выживания и пролиферации ,
Недавнее исследование поставило под сомнение общую применимость аутоиммунной гипотезы (Lenze et al., 2006). Из семи анализируемых одноцепочечных антител, клонированных из MALT-лимфомы, только один реагировал с аутоантигеном, специфичным для плазменной клетки белком Ufc1 (рис. 4.7B и C). Другие не проявляли реактивности в экранах с исчерпывающей экспрессией и библиотеками пептидов. В более крупных исследованиях еще не видно, какая доля MALT-лимфомы экспрессирует аутореактивные антитела и какие дополнительные (авто) -антигены могут быть идентифицированы.
Патогенез поздней, Helicobacter pylori-независимой MALT-лимфомы: влияние хромосомных транслокаций
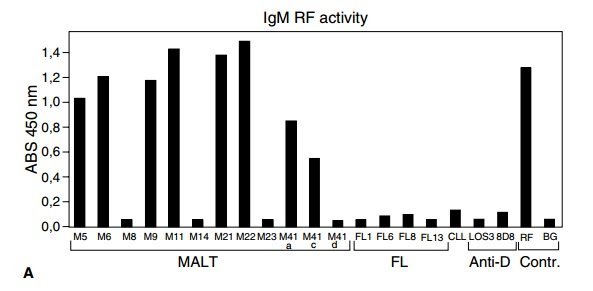
Автореактивность опухолевых иммуноглобулинов. (A) Ревматоидный фактор (RF) активности антител, полученных из лимфомы идиотипа (LIDA). Связывающая активность иммуноглобулина (Ig) M LIDAs, контрольной сыворотки RF и анти-Rh (D) -контроля IgM Abs (LOS3 и 8D8) в IgM-RF
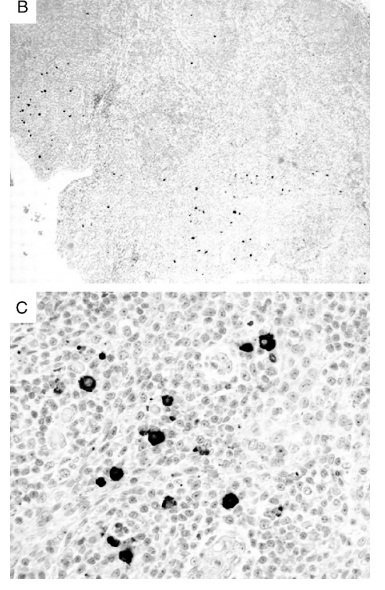
Все образцы испытывали при стратифицированной концентрации 500 нг / мл IgM. На диаграмме показана длина волны 450 нм. (B) и (C) Иммуногистохимическое окрашивание миндалины человека с помощью одноцепочечного вариабельного антитела пациента. Обзор (B) и деталь (C) структуры распределения и морфологии положительных клеток. (A: Воспроизводится из Bende et al., University of Rockefeller Press. Copyright 2005. B и C: Это исследование было первоначально опубликовано в Lenze и др. 2006. © Американское общество гематологии.)
Неходжкинские лимфомы имеют характерные хромосомные изменения, которые обычно специфичны для подтипа. Наиболее известным является t (14; 18) (q32; q21), что приводит к избыточной экспрессии Bcl-2 в фолликулярной лимфоме. В MALT-лимфоме выявлены три хромосомные транслокации, которые влияют на различные гены и происходят с различными частотами в определенных анатомических сайтах. Следует отметить, что все три транслокации влияют на сигнальный путь NF-kB, который в В-клетках регулирует антигензависимую активацию, пролиферацию, выживание и индукцию эффекторных функций. Конечным результатом всех трех транслокаций является повышенная пролиферация и ингибирование апоптоза, тем самым давая преимущество роста затронутым клеткам.
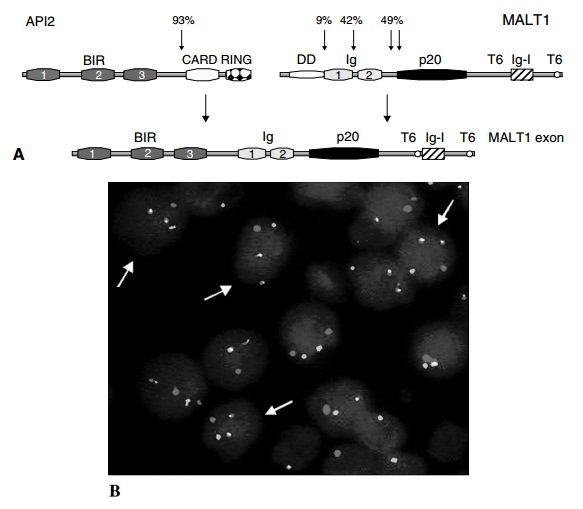
Структура генов API2 и MALT1. Стрелки указывают известные точки останова и их частоты. BIR: бакуловирусный ингибитор повторения апоптоза; КАРТОЧКА: домен кадрового рекрутинга; DD: домен смерти; RING: действительно интересный новый ген; P20: каспазоподобный домен p20: Ig-I: иммуноглобулиноподобный домен; T6: сайт связывания TRAF6. (B) картина интерфазной флуоресценции in situ гибридизации (FISH) (11; 18) / API2-MALT1. FISH с двухцветным двухканальным транслокационным зондом API2 / MALT1 показывает колокализацию красного и зеленого сигналов (стрелки). (A: перепечатано из Sagaert et al., 2007, с разрешения издательства Macmillan. Copyright 2007. B: перепечатано из Nakamura et al., 2007, с разрешения издательской группы BMJ.) (См. Цветные пластины)
Транслокация t (11; 18) (q21; q21) сливает ген ингибитора апоптоза 2 (API2) на хромосоме 11q21 с геном MALT1 на хромосоме 18q21, в результате чего образуется новый химерный белок API2-MALT1 (рисунок 4.8A) (Dierlamm et Al., 1999). Это наиболее часто наблюдаемая хромосомная транслокация в MALT-MALT-лимфомах и обычно диагностируется с помощью флуоресценции in situ гибридизации (рис. 4.8B) или обратной транскриптазы (RT) -PCR. Эта транслокация особенно распространена в MALT-лимфомах желудка и легких MALT и почти никогда не встречается в MALT-MALT-лимфомах других анатомических сайтов. Зарегистрированные показатели варьируются от 24% до 48% желудочной MALT-лимфомы, в зависимости от исследования. Лимфомы с этой транслокацией обычно не реагируют на эрадикационную терапию H.pylori и, скорее всего, распространяются на локальные лимфатические узлы или отдаленные участки (Liu et al., 2001a, 2001b). Однако t (11; 18) (q21; q21) -положительные MALT-лимфомы не связаны с полноценной трансформацией и генетически стабильны, то есть они редко содержат дополнительные клональные аберрации (рис. 4.9) (Starostik et al., 2002). Напротив, t (11; 18) (q21; q21) -негативные опухоли часто показывают трисомию хромосом 3, 12 и 18, а также другие аберрации (рис. 4.9). Слитый белок API2-MALT1 содержит N-концевую область API2, ингибитор каспазы, с тремя последовательными доменами BIR (бакуловирус IAP-повторов), а также каспазоподобный домен С-конца MALT1. Полноразмерный белок MALT1 является важным компонентом антиген-рецептор-зависимой активации NF-kB в лимфоцитах. Считается, что слитый белок выводит свои онкогенные свойства посредством олигомеризации через его BIR-домены (McAllister-Lucas et al., 2001).

Структура аллельных дисбалансов в MALT лимфоме желудка и их связь с t (11; 18). Проанализированные хромосомные области показаны в верхней части каждой колонки. Пациенты перечислены в первом столбце с их статусом t (11; 18), который был обнаружен с помощью флуоресцентной гибридизации in situ (FISH) (ND: не проведен) или обратной цепной реакции с обратной транскриптазой-полимеразой (RT-PCR) (NA: без амплификата) Заданные во втором и третьем столбцах соответственно. Указывается состояние каждого локуса: горизонтальные полосы, сохранение гетерозиготности; Диагональные полосы, не информативные; Вертикальные полосы, без усиления; Пустые бары, амплификация геномной ДНК; И черные полосы, LOH. (Это исследование было первоначально опубликовано в Starostik et al., 2002. © Американское общество гематологии.)
Транслокация t (1; 14) (p22; q32) также встречается в продвинутых и эрадикационно-резистентных MALT-лимфомах (Ye et al., 2003). Он затрагивает только около 5% всех MALT-лимфомы. Транслокация связывает ген BCL10 с локусом Ig, тем самым вызывая экспрессию Bcl-10 под контролем сильного гена-энхансера тяжелой цепи Ig (Willis et al., 1999; Zhang et al., 1999). Это приводит к сверхэкспрессии Bcl-10 и ядерной локализации. Исследования у мышей с нокаутом BCL10 показали, что белок необходим для развития и функционирования лимфоцитов, где он является частью антиген-рецепторного сигнального пути, активирующего NF-kB (Ruland et al., 2001; Xue et al., 2003). Нокаутные мыши заметно иммунодефицитные из-за дефектной активации NF-kB. Напротив, мыши, которые экспрессируют трансгенный Bcl-10 под контролем энхансера IgH, характеризуются расширением селезеночной маргинальной зоны в соответствии с ролью Bcl-10 в регуляции пролиферации B-клеток маргинальной зоны (Morris et al. 2001).
Транслокация t (14; 18) (q32; q21) сопоставляет ген MALT1 с энхансером тяжелой цепи Ig, тем самым вызывая его сверхэкспрессию (Sanchez-Izquierdo et al., 2003; Streubel et al., 2003). Эта транслокация затрагивает приблизительно 20% MALT-лимфомы и чаще встречается в MALT-лимфомах не-GI MALT. В клетках лимфомы, укрывающих t (14; 18) (q32; q21), MALT1 и Bcl-10 сверхэкспрессируются в цитоплазме (Sanchez-Izquierdo et al., 2003).
Исследования у нокаутных мышей нашли синергические роли для Bcl-10 и MALT1 в активации NF-kB после сшивания антиген-рецептора в Т-клетках, и, вероятно, подобные механизмы существуют в В-клетках. Согласно этой модели, адаптер CARD11, расположенный на липид-плот, образует тройной комплекс с Bcl-10 и MALT1 при распознавании антигена рецептора Т-клеток. Это взаимодействие индуцирует олигомеризацию MALT1, который, в свою очередь, может связывать и индуцировать олигомеризацию и активацию связанного с TNF рецептора фактора 6 (TRAF6). Активированный TRAF6 взаимодействует с ubiquitin-конъюгирующим ферментом (E2) и опосредует полиубиквитилирование NEMO / IKKg. Multiubiquitylated NEMO активирует IKKs a и b, которые фосфорилируют и вызывают деградацию IkB и высвобождение NF-kB.
Если Bcl-10 сверхэкспрессируется в B-клетках в результате транслокации t (1; 14) (p22; q32), он олигомеризуется через свой домен CARD и сочетает сигнальный путь путем запуска олигомеризации MALT1 антиген-независимым образом. MALT1, напротив, не может олигомеризоваться сам по себе, поскольку в нем отсутствуют требуемые структурные домены. В клетках, которые поддерживают транслокацию t (14; 18) (q32; q21) (и, следовательно, сверхэкспрессируют MALT1), в цитоплазме наблюдаются высокие уровни как MALT1, так и Bcl-10 (Sanchez-Izquierdo et al., 2003), что указывает на то, что MALT1 может связываться с Bcl-10 и стабилизировать его. Это взаимодействие может активировать NF-kB в отсутствие связывания антигена. В случае транслокации t (11; 18) (q21; q21), продуцирующей слитый белок API2-MALT1, предполагается, что BIR-домены, внесенные N-концами API2, индуцируют олигомеризацию слитого белка и устраняют потребность в Bcl -10 (McAllisterLucas et al., 2001). В дополнение к своей (нормальной) цитоплазматической локализации Bcl-10 обнаруживается в ядрах t (1; 14) (p22; q32) -положительных и t (11; 18) (q21; q21) -положительных клетках MALT-лимфомы, Но онкогенный потенциал ядерного Bcl-10 остается неясным.
Молекулярные механизмы трансформации высокого ранга
Низкосортная MALT-лимфома MALT может трансформироваться в (полноценную) диффузную большую В-клеточную лимфому (DLBCL), которая патогенетически отличается от ее узлового аналога несколькими способами. Например, перегруппировка BCL2 часто встречается в узловых DLBCL, но отсутствует в желудочном DLBCL (Cogliatti et al., 2000). И наоборот, высокая частота перегруппировок MYC наблюдается в желудочном DLBCL, тогда как они встречаются редко в узловой аналогии. Неясно, происходят ли все DLBCL желудка из низкосортной MALT-лимфомы или существуют ли другие патогенетические механизмы. Наиболее изученным фактором, который, как считается, связан с полноценной трансформацией, является Bcl-6. Bcl-6 обычно функционирует в качестве транскрипционного переключателя, контролирующего образование зародышевого центра, и его регулируют по мере того, как лимфоциты в GC дифференцируются в память B или плазматические клетки. В результате Bcl-6 высоко экспрессируется в нормальных GC-клетках, а также в новообразованиях, полученных из GC-клеток, таких как фолликулярная MALT-лимфома. Напротив, низкосортная MALT-лимфома MALT обычно отрицательна для Bcl-6, а также другого GC-маркера CD10, что соответствует его выведению из B-клеток маргинальной зоны. Таким образом, иммуноокрашивание для Bcl-6 и CD10 играет важную роль в дифференциальной диагностике злокачественных новообразований B-клеток с различными нормальными клеточными аналогами (Dogan et al., 2000).
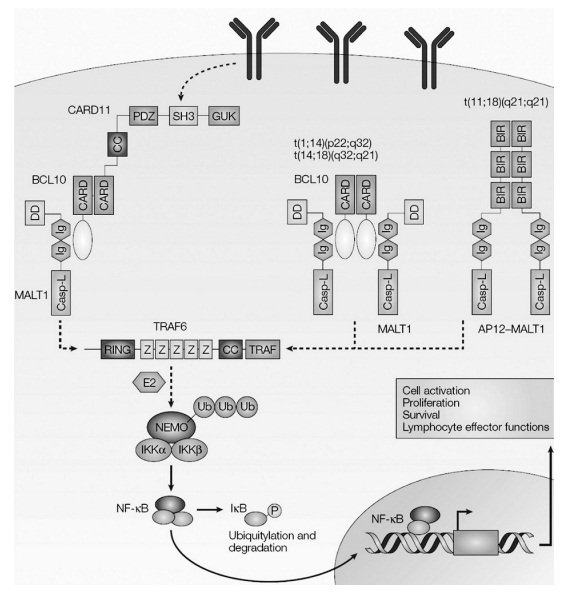
Различные хромосомные транслокации, вовлеченные в лимфому MALT, влияют на общий молекулярный путь. После стимуляции антиген-рецептором CARD11 активируется для набора BCL10 через взаимодействие с каспазным вербовкой (CARD) -CARD, и это вызывает олигомеризацию BCL10 (для простоты события олигомеризации не показаны). BCL10 затем связывает иммуноглобулиновый (Ig) -подобный домен слизистой оболочки лимфоидной ткани лимфомы лимфатической лимфомы 1 (MALT1) через короткую область ниже по потоку от ее CARD и индуцирует олигомеризацию MALT1. Олигомеризованный MALT1 связывается с фактором 6 рецептора фактора некроза опухолей (TRAF6) и индуцирует его олигомеризацию, что приводит к активации активности 109 убиквитин-лигазы TRAF6. Активированный TRAF6 взаимодействует с конъюгирующим ubiquitin ферментом (E2) и опосредует полиубиквитилирование ядерного фактора -KB (NF-kB) -элементный модулятор (NEMO), который также известен как IkB киназа-g (IKKg). По механизмам, которые не полностью понятны, мультибиквитилированный NEMO индуцирует активацию IKKa и IKKb, что вызывает фосфорилирование и деградацию IkB и высвобождение NF-kB. Затем NF-kB транслоцирует на ядро и трансактивирует гены, важные для клеточной активации, пролиферации и выживания, а также индукции эффекторных функций лимфоцитов. В лимфомах MALT, включающих t (1; 14) (p22; q32), BCL10 помещают под регуляцию усилителей гена тяжелой цепи Ig и сверхэкспрессируют. Считается, что в этих лимфомах BCL10 образует олигомеры через свой домен CARD без необходимости восходящих сигналов, что приводит к конститутивной активации NF-kB. В лимфомах MALT с t (14; 18) (q32; q21) MALT1 помещают под контроль энхансера гена тяжелой цепи Ig и сверхэкспрессируют. В этих опухолях олигомеризация и активация MALT1, как полагают, зависят от BCL10. В лимфомах MALT с t (11; 18) (q21; q21) полученный продукт слияния API2-MALT1, как полагают, самоолигомеризуется через baculovirus IAP repeat (BIR) домен молекулы API2, поэтому приводит к конститутивной NF-kB Мероприятия. Casp-L: каспазоподобный домен; CC: спиральная катушка; DD: домен смерти; GUK: гуанилат-киназ-подобный домен; SH3: Src homology 3 domain; Ub: убиквитин; Z: цинковый палец. (Перепечатано из Исааксона и Ду 2004, с разрешения издательства Макмиллан. Copyright 2004.)
Высококачественные желудочные (и неглазные) DLBCL гетерогенны в терминах экспрессии Bcl-6. Действительно, иммуноокрашивание для Bcl-6, а также CD10 и MUM1 может быть использовано для классификации DLBCL в подгруппах GC B-cell (GCB) и не GCB с прогностическим значением (Chen et al., 2006). Случаи с высокой экспрессией Bcl-6 обычно имеют более благоприятный прогноз. Выражение Bcl-6 может быть отменено по меньшей мере тремя различными механизмами. С одной стороны, мутации в двух «связывающих мотивах BCL6» BSE1A и BSE1B могут препятствовать связыванию Bcl-6 с его собственным промотором, нарушая тем самым его отрицательную авторегуляцию. Эти мутации всегда связаны с высокой экспрессией Bcl-6 и встречаются примерно в 25% случаев DLBCL (Chen et al., 2006). С другой стороны, хромосомные транслокации с участием гена BCL6 сопоставляют свою 5′-регуляторную область с промоторной областью Ig-гена; Также были обнаружены слияния с другими конститутивно экспрессируемыми генами, не являющимися Ig. Приблизительно 40% DLBCL несут транслокации BCL6, которые также обычно связаны с высокой экспрессией продукта гена (Chen et al., 2006). Ни сегрегационные мутации, ни транслокации с участием Bcl-6 не обнаруживаются на высокой частоте в низкосортных MALT-MALT-лимфомах. Поэтому было высказано предположение о том, что трансформация с низким и высоким содержанием происходит посредством мутаций или транслокаций гена BCL6. Транслокации, включающие Ig-гены, в частности, могут возникать во время ошибочного переключения класса изотипа Ig, которое, как было показано, происходит в пропорции лимфомы желудка MALT. Наличие многих реакционноспособных фолликулов в MALT-лимфоме может обеспечить установку для обоих типов генетических изменений BCL6, что приводит к полноценной трансформации.
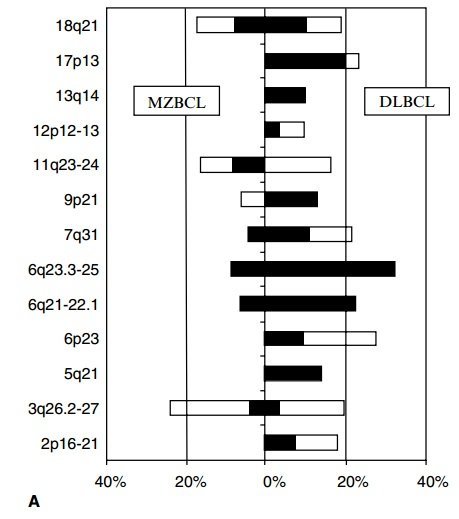
(A) Сравнение аллелотипов низкосортной лимфомы MALT (лимфома B-клеток маргинальной зоны, MZBCL) и полноценного DLBCL (диффузная большая В-клеточная лимфома). Частота аллельного дисбаланса (процент информативных анализов) в отдельных регионах выражается в виде диаграммы: открытый бар, усиление; Черный брусок, LOH. Левая часть показывает результаты для MZBCL; Правая часть, результаты для DLBCL. (B) Два пути развития лимфомы желудка MALT из нормальных клеток (NC). Первый характеризуется t (11; 18); Особенно эти лимфомы редко накапливают дополнительные генетические аберрации и, похоже, не превращаются в DLBCL. С другой стороны, t (11; 18) -негативные опухоли приобретают различные генетические аберрации, иллюстрируемые усилением 3q26.2-27, и некоторые из них могут в конечном итоге превратиться в полноценный DLBCL (перечисленные являются одними из наиболее распространенных дополнительных аберраций). В случае отображения абзаца 6q может быть основным DLBCL. (Это исследование было первоначально опубликовано в Starostik et al., 2002. © Американское общество гематологии.)
Третий механизм дерегулирования Bcl-6 включает усиление области 3q26.2-3q27. Эта область на хромосоме 3 содержит гены, кодирующие Bcl-6 и каталитическую субъединицу фосфатидилинозитол-3-киназы, которая участвует в качестве онкогена при раке яичников. Было показано, что в исследовании, сравнивающем генетические аномалии в лимфоме желудка MALT и желудочном DLBCL с помощью микросателлитного скрининга, было показано, что амплификация области 3q26,2-3q27 является наиболее частым аллельным дисбалансом, влияющим на оба субъекта заболевания (приблизительно 20%) (Starostik et al. 2002). Этот и несколько других аллельных дисбалансов разделялись t (11; 18) (q21; q21) -негативными MALT-лимфомами MALT и желудочным DLBCL (рис. 4.11), тогда как t (11; 18) (q21; q21) -положительные случаи MALT-лимфомы были генетически устойчивы, т. Е. Не приобретают дополнительных генетических аберраций (рис. 4.9, 11А). В целом частота аберраций была значительно ниже в случаях MALT-лимфомы по сравнению с DLBCL. Отдельная подгруппа аллельных дисбалансов уникальна для случаев DLBCL и никогда не обнаруживается ни в одном из случаев MALT-лимфомы. Гены, затронутые этими аберрациями, являются хорошими дополнительными кандидатами на роль в переходе с низким до высокого уровня. Среди аберраций в этой группе LOH наблюдается в областях 5q21 (локус гена APC), 9p21 (INK4A / ARF), 13q14 (RB) и 17p13 (p53) (Starostik et al., 2002). Действительно, полная инактивация супрессора опухоли р53 путем мутации или делеции наблюдалась в DLBCL также в независимых исследованиях (например, Du et al., 1995), так как имеет инактивацию гена INK4A, кодирующего ингибитор циклинзависимой киназы, и отрицательный регулятор Клеточный цикл (Neumeister et al., 1997).
Исходя из сходства и различий в аллельных дисбалансах, обнаруженных в обеих группах опухолей, было предложено, чтобы желудочные лимфомы развивались вдоль двух различных путей (Starostik et al., 2002). Одна группа опухолей развивается по пути, определяемому дисрегуляцией генов API2 и MALT1, вызванных t (11; 18). Эти опухоли не накапливают достаточное количество вторичных генетических аберраций, чтобы трансформироваться в DLBCL и оставаться на стадии MALT-лимфомы. Напротив, MALT-лимфомы, характеризующиеся отсутствием t (11; 18) и повышенным накоплением различных генетических аномалий, чаще всего амплификация 3q26,2-27, могут быть источником опухолей, которые в конечном итоге превращаются в полноценный DLBCL ( Starostik et al., 2002). Основываясь на дополнительном нахождении, что многие DLBCL не содержат каких-либо общих аномалий, он далее предположил, что DLBCL можно разделить на две группы: одну, которая проистекает из низкосортной копии (характеризующейся 3q27 и другими общими аберрациями) и Который развивает de novo (Starostik et al., 2002).